题目内容
3.我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人.那么,这种做法的化学原理是( )| A. | 胶体的电泳 | B. | 血液的氧化还原反应 | ||
| C. | 血液中发生复分解反应 | D. | 胶体的聚沉 |
分析 胶体在遇到电解质溶液、加热、电性相反的电解质的时候都会聚沉,结合题目中所给信息解答即可.
解答 解:A、血液属于胶体,因为没有外接电源,所以不属于电泳现象,故A错误.
B、血液和氯化钠不发生氧化还原反应,故B错误;
C、血液和氯化钠不具备复分解反应的条件,所以不发生复分解反应,故C错误;
D、血液属于胶体,所以血液应具备胶体的性质,在遇到电解质溶液、加热、电性相反的电解质的时候都会聚沉;在伤口上撒盐可以使伤口表面的血液凝结,从而阻止进一步出血,以及防治细菌感染,属于胶体的聚沉,故D正确;
故选D.
点评 本题主要考查的是胶体的性质,了解胶体的性质并与生活中的常见胶体性质的利用是解决本题的关键,难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
9.下列说法中,正确的是(NA表示阿伏加德罗常数)( )
| A. | 标准状况下,22.4L的水所含有的分子数是NA | |
| B. | 常温常压下,11.2L CO2的中所含O原子数为NA | |
| C. | 32g氧气在标准状况下所占的体积与相同条件下NA个N2分子所占的体积相同 | |
| D. | 标准状况下,11.2L NO、NO2混合气体含有的氮原子数为NA |
17.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,瑞士科学家库尔特、维特里希等人为此获得2002年诺贝尔化学奖.下列有关13C、15N的叙述正确的是( )
| A. | 15N与14N互为同位素 | B. | 13C与C60互为同素异形体 | ||
| C. | 13C、15N具有相同的中子数 | D. | 15N的核外电子数与中子数相同 |
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 22.4 L 乙烯和丙烯的混合气体中分子数为NA | |
| B. | 一定温度下,15 g甲醛和葡萄糖的混合物含O原子数为0.5 NA | |
| C. | 常温常压下,8.8 g乙酸乙酯中含有C-O键的个数为0.5 NA | |
| D. | 4 mL 15 mol•L-1浓硝酸与足量铜反应,生成NO2的分子数约为0.03 NA个 |
18.下列对化学用语的理解正确的是( )
| A. | Na218O中氧离子的结构示意图: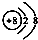 | |
| B. | 比例模型 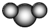 ,表示二氧化碳或水分子 ,表示二氧化碳或水分子 | |
| C. | 碳正离子 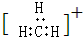 中质子数与电子数之比值为3:2 中质子数与电子数之比值为3:2 | |
| D. | TNT 结构简式: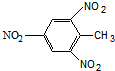 |
8.有五瓶溶液分别是:
①10mL 0.60moL•L-1NaOH溶液
②20mL 10.50moL•L-1H2SO4溶液
③30mL0.40moL•L-1HCl溶液
④40mL0.30moL•L-1CH3COOH溶液
⑤50mL0.20moL•L-1蔗糖水溶液.
以上各瓶溶液所含离子、分子总数的大小顺序是( )
①10mL 0.60moL•L-1NaOH溶液
②20mL 10.50moL•L-1H2SO4溶液
③30mL0.40moL•L-1HCl溶液
④40mL0.30moL•L-1CH3COOH溶液
⑤50mL0.20moL•L-1蔗糖水溶液.
以上各瓶溶液所含离子、分子总数的大小顺序是( )
| A. | ⑤>④>③>②>① | B. | ②>①>③>④>⑤ | C. | ②>③>④>①>⑤ | D. | ①>②>③>④>⑤ |
15.下列由短周期元素形成的离子化合物中,阳离子半径与阴离子半径之比最大的是( )
| A. | LiCl | B. | Na2O | C. | NaF | D. | MgS |
12.下列酸性氧化物和水化物的关系不对应的是( )
| A. | SiO2 H4SiO4 | B. | Cl2O HClO4 | C. | Mn2O7 HMnO4 | D. | N2O5 HNO3 |
18.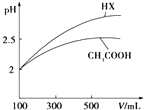 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时HX的电离平衡常数_大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 0.75mol•L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时HX的电离平衡常数_大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 0.75mol•L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).