题目内容
6.对于第三周期元素的有关叙述错误的是( )| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | |
| B. | 电负性:Si<P<S | |
| C. | 第一电离能:Na<Mg<Al | |
| D. | Cl-核外电子排布式:1s22s22p63s23p6 |
分析 A.金属性:Na>Mg>Al,元素的金属性越强,对应最高价氧化物的水化物的碱性越强;
B.元素的非金属性越强,电负性越强;
C.同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;
D.氯离子核外有18个电子.
解答 解:A.金属性:Na>Mg>Al,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则碱性:NaOH>Mg(OH)2>Al(OH)3,故A正确;
B.元素的非金属性:Si<P<S,所以电负性:Si<P<S,故B正确;
C.同一周期元素的第一电离能随着原子序数的增大而增大,同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的,所以第一电离能Na<Al<Mg,故C错误;
D.氯离子核外有18个电子,所以Cl-核外电子排布式:1s22s22p63s23p6,故D正确;
故选C.
点评 本题考查了元素金属性、非金属性的判断依据、元素性质的递变规律,题目难度小属于基础题,注意理解并记住相应的递变规律.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
12.在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,不同时刻测得生成O2的体积(已这算为标准状况)如下表.下列叙述不正确的是(溶液体积变化忽略不计)( )


| A. | 0-6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6-10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应到6min时,H2O2分解了50% | |
| D. | 反应到6min时,c(H2O2)=0.30mol/L |
20.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 3.6g重水中含有的中子数为2NA | |
| B. | 16.0g的过氧(根)离子中含有的电子数为9NA | |
| C. | 100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3NA | |
| D. | 含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2分子数为NA |
17.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,瑞士科学家库尔特、维特里希等人为此获得2002年诺贝尔化学奖.下列有关13C、15N的叙述正确的是( )
| A. | 15N与14N互为同位素 | B. | 13C与C60互为同素异形体 | ||
| C. | 13C、15N具有相同的中子数 | D. | 15N的核外电子数与中子数相同 |
1.氢核聚变能产生大量的能量,而高纯度铍(Be)是制造核聚变反应装置中最核心的部件之一的屏蔽包的主要材料.据中新网2009年2月6日报道,我国科学家己成功地掌握了获取高纯度铍的技术.下列有关说法错误的是( )
| A. | 10Be、9Be、8Be核内质子数均是4 | |
| B. | Be元素在元素周期表的p区 | |
| C. | 氢核聚变后会产生新元素 | |
| D. | 从矿物中提取单质铍的过程中铍一定被还原 |
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 22.4 L 乙烯和丙烯的混合气体中分子数为NA | |
| B. | 一定温度下,15 g甲醛和葡萄糖的混合物含O原子数为0.5 NA | |
| C. | 常温常压下,8.8 g乙酸乙酯中含有C-O键的个数为0.5 NA | |
| D. | 4 mL 15 mol•L-1浓硝酸与足量铜反应,生成NO2的分子数约为0.03 NA个 |
18.下列对化学用语的理解正确的是( )
| A. | Na218O中氧离子的结构示意图: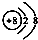 | |
| B. | 比例模型 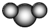 ,表示二氧化碳或水分子 ,表示二氧化碳或水分子 | |
| C. | 碳正离子 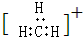 中质子数与电子数之比值为3:2 中质子数与电子数之比值为3:2 | |
| D. | TNT 结构简式: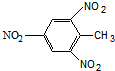 |
15.下列由短周期元素形成的离子化合物中,阳离子半径与阴离子半径之比最大的是( )
| A. | LiCl | B. | Na2O | C. | NaF | D. | MgS |
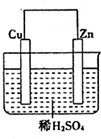 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )