题目内容
20.下列说法正确的是( )| A. | 同周期主族元素简单离子的半径随核电荷数的增加而减小 | |
| B. | 同主族元素含氧酸的酸性随核电荷数的增加而降低 | |
| C. | 质子数相同的微粒化学性质也相同 | |
| D. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U具有相同的核外电子排布 |
分析 A.电子层数越多,离子半径越大;
B.同主族元素形成的最高价氧化物对应的含氧酸的酸性随核电荷数的增加而减弱;
C.具有相同质子数的原子一定属于同种元素,但微粒可能为原子、分子、离子等;
D.同位素质子数相同,所以核外电子排布相同.
解答 解:A.电子层数越多,离子半径越大,Na+有两个电子层,Cl-有三个电子层,则半径:Cl->Na+,故A错误;
B.同主族元素形成的最高价氧化物对应的含氧酸的酸性随核电荷数的增加而减弱,不是最高价氧化物的水化物则没有该规律,故B错误;
C.氢气和氦的质子数相同,但化学性质完全不同,故C错误;
D.同位素质子数相同,所以核外电子排布相同,故D正确;
故选D.
点评 本题考查原子结构和及微粒的性质,题目难度不大,注意具有相同质子数的原子一定属于同种元素,但微粒可能为原子、分子、离子等.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
13.下列离子方程式中,不正确的是( )
| A. | 在稀NaOH溶液中通入过量的CO2:OH-+CO2═HCO3- | |
| B. | 稀硫酸中加入NaOH溶液:H++OH-═H2O | |
| C. | Na2CO3溶液中加入少量的盐酸:CO32-+H+═HCO3- | |
| D. | 碳酸钙溶于稀醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O |
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 22.4 L 乙烯和丙烯的混合气体中分子数为NA | |
| B. | 一定温度下,15 g甲醛和葡萄糖的混合物含O原子数为0.5 NA | |
| C. | 常温常压下,8.8 g乙酸乙酯中含有C-O键的个数为0.5 NA | |
| D. | 4 mL 15 mol•L-1浓硝酸与足量铜反应,生成NO2的分子数约为0.03 NA个 |
8.有五瓶溶液分别是:
①10mL 0.60moL•L-1NaOH溶液
②20mL 10.50moL•L-1H2SO4溶液
③30mL0.40moL•L-1HCl溶液
④40mL0.30moL•L-1CH3COOH溶液
⑤50mL0.20moL•L-1蔗糖水溶液.
以上各瓶溶液所含离子、分子总数的大小顺序是( )
①10mL 0.60moL•L-1NaOH溶液
②20mL 10.50moL•L-1H2SO4溶液
③30mL0.40moL•L-1HCl溶液
④40mL0.30moL•L-1CH3COOH溶液
⑤50mL0.20moL•L-1蔗糖水溶液.
以上各瓶溶液所含离子、分子总数的大小顺序是( )
| A. | ⑤>④>③>②>① | B. | ②>①>③>④>⑤ | C. | ②>③>④>①>⑤ | D. | ①>②>③>④>⑤ |
15.下列由短周期元素形成的离子化合物中,阳离子半径与阴离子半径之比最大的是( )
| A. | LiCl | B. | Na2O | C. | NaF | D. | MgS |
5.下列离子方程式中不正确的是( )
| A. | 亚硫酸钡与盐酸反应:BaSO3+2H+=Ba2++SO2↑+H2O | |
| B. | 少量二氧化碳通入足量的NaOH溶液:CO2+OH-=HCO${\;}_{3}^{-}$ | |
| C. | 澄清石灰水跟盐酸反应:H++OH-=H2O | |
| D. | 亚硫酸氢钠溶液与NaOH溶液反应:HSO${\;}_{3}^{-}$+OH-=SO${\;}_{3}^{2-}$+H2O |
12.下列酸性氧化物和水化物的关系不对应的是( )
| A. | SiO2 H4SiO4 | B. | Cl2O HClO4 | C. | Mn2O7 HMnO4 | D. | N2O5 HNO3 |
14.已知由石墨制备金刚石的反应为:C(石墨)$\frac{\underline{\;一定条件\;}}{\;}$C(金刚石);△H>0,则下列两个反应中:C(石墨)+O2(g)═CO2(g);△H=a kJ/mol,C(金刚石)+O2(g)═CO2(g);△H=b kJ/mol,a与b的关系为( )
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
15.下列物质互为同分异构体的一组是( )
| A. | 35Cl和37Cl | B. | CH3COOH和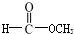 | C. | O2和O3 | D. | CH2=CH2和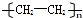 |