题目内容
4.下列离子方程式正确的是( )| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应 2CH3COOH+Cu(OH)2═(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O═2C6H5OH+CO32- | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
分析 A.乙酸为弱电解质,保留化学式;
B.醋酸铜为可溶性盐,拆成离子形式;
C.苯酚钠溶液中通入少量二氧化碳反应生成苯酚与碳酸氢钠;
D.AlCl3溶液中加入过量氨水反应生成氢氧化铝和氯化铵.
解答 解:A.乙酸与碳酸钠溶液反应,离子方程式:2CH3COOH+CO32-═CO2↑+H2O+2CH3COO-,故A错误;
B.醋酸溶液与新制氢氧化铜反应,离子方程式:2CH3COOH+Cu(OH)2═2CH3COO-+Cu2++2 H2O,故B错误;
C.苯酚钠溶液中通入少量二氧化碳,离子方程式:C6H5O-+CO2+H2O═C6H5OH+CHO3-,故C错误;
D.AlCl3溶液中加入过量氨水,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.对下列各图曲线表征的信息解毒错误的是( )
| A. | 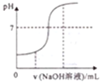 向酸性溶液中滴加NaOH溶液时pH随NaOH溶液体积变化关系 | |
| B. |  某反应为放热反应,催化剂能改变反应的焓变 | |
| C. |  不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. | 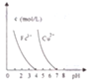 pH=7时,Cu2+、Fe3+都能沉淀完全 |
19.常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )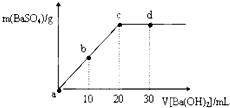

| A. | 硫酸溶液的体积为30 mL | |
| B. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 | |
| C. | d时刻溶液的pH约为13 | |
| D. | 溶液的导电能力:c<d=b<a |
9.取x g铜和镁的合金完全溶于浓硝酸,若反应中硝酸被还原只产生8960mL NO2气体和672mL N2O4气体(都已折算成标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为17.02g,则x等于( )
| A. | 8.64 g | B. | 9.00 g | C. | 9.20 g | D. | 9.44 g |
16.能够鉴定溴乙烷中存在溴元素的实验操作是( )
| A. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液 | |
| B. | 加入NaOH溶液加热,冷却后加入稀硝酸酸化,然后加入AgNO3溶液 | |
| C. | 在溴乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 |
13.根据图示装置,下列说法不正确的是( )
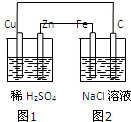

| A. | 装置中图1为原电池,图2为电解池 | |
| B. | 图2中Fe电极上的电极反应式为:2C1--2e一═C12↑ | |
| C. | 图1、图2溶液中的H+分别向Cu、Fe电极移动 | |
| D. | 该装置工作一段时间后,图1、图2溶液的pH均增大 |
14.18O是一种示踪原子,用来探究反应历程.在密闭容器中加入CO和H218O发生反应CO+H218O═CO2+H2,一段时间后达到平衡,18O存在于下列哪些微粒中( )
| A. | 只存在于CO2中 | B. | 只存在于CO中 | ||
| C. | 存在于CO2和H2O中 | D. | 存在于CO、H2O和CO2中 |
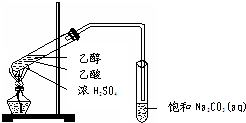 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味. 四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示:
四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示: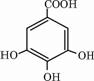 .
.