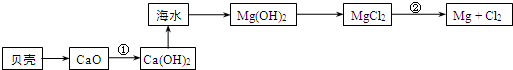
题目内容
9.取x g铜和镁的合金完全溶于浓硝酸,若反应中硝酸被还原只产生8960mL NO2气体和672mL N2O4气体(都已折算成标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为17.02g,则x等于( )| A. | 8.64 g | B. | 9.00 g | C. | 9.20 g | D. | 9.44 g |
分析 铜和镁失去的电子的物质的量,等于硝酸被还原为二氧化氮、四氧化二氮获得的电子的物质的量,等于他们结合的氢氧根的物质的量,根据氮的氧化物计算氢氧根的物质的量,沉淀的总质量减去氢氧根的质量即为金属的质量.
解答 解:8960mL的NO2气体的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,672mL的N2O4气体的物质的量为:$\frac{0.672L}{22.4L/mol}$=0.03mol,
则金属提供的电子的物质的量为:0.4mol×(5-4)+0.03mol×2×(5-4)=0.46mol,
铜和镁失去的电子的物质的量,等于硝酸被还原为二氧化氮、四氧化二氮获得的电子的物质的量,等于他们结合的氢氧根的物质的量,
故沉淀中含有氢氧根的物质的量为0.46mol,氢氧根的质量为:0.46mol×17g/mol=7.82g,
所以金属的质量为:17.02g-7.82g=9.20g,
故选C.
点评 本题考查混合物的计算,题目难度中等,本题解答的关键是铜和镁失去的电子的物质的量,等于他们结合的氢氧根的物质的量,而结合氢氧根的质量就正好是质量增加的量.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
20.下列有关实验的现象与对应结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有大量的水 |
| B | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有氧化性 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 过氧化钠作呼吸面具中的供氧剂 | 淡黄色粉末变白 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |
17.下列粒子属等电子体的是( )
| A. | SO2和O3 | B. | CH4和NH4+ | C. | NH2-和H2O2 | D. | HCl和H2O |
4.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应 2CH3COOH+Cu(OH)2═(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O═2C6H5OH+CO32- | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
18.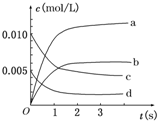 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
(1)用O2表示0~2s内该反应的平均速率v=0.0015mol/(L•s);
(2)图中a、b、c、d四条曲线中表示SO3浓度随时间变化的是b;
(3)恒温恒容条件下,能说明该反应已达到平衡状态的是BC.
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v逆(SO2)=2v正(O2) D.容器内密度保持不变.
 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:| 时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中a、b、c、d四条曲线中表示SO3浓度随时间变化的是b;
(3)恒温恒容条件下,能说明该反应已达到平衡状态的是BC.
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v逆(SO2)=2v正(O2) D.容器内密度保持不变.
19.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+11.9kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在25℃,101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |