题目内容
14.18O是一种示踪原子,用来探究反应历程.在密闭容器中加入CO和H218O发生反应CO+H218O═CO2+H2,一段时间后达到平衡,18O存在于下列哪些微粒中( )| A. | 只存在于CO2中 | B. | 只存在于CO中 | ||
| C. | 存在于CO2和H2O中 | D. | 存在于CO、H2O和CO2中 |
分析 CO和H218O发生反应CO+H218O═CO2+H2,该反应是可逆反应,O原子反应后都生成了二氧化碳,逆向反应时,二氧化碳中的2个O原子分别生成CO和水,据此分析.
解答 解:从反应方程式可知,反应物中的2molO原子反应后生成二氧化碳,逆向反应时,二氧化碳中的2molO原子分别生成CO和水,且二氧化碳中的2个O原子没有区别,所以18O可能存在于CO、H2O和CO2中,故选D.
点评 本题考查了可逆反应中示踪原子的存在物质,明确反应实质是解题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应 2CH3COOH+Cu(OH)2═(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O═2C6H5OH+CO32- | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
5.下列说法正确的是( )
| A. | 离子半径大小:F->Na+>Mg2+ | B. | 金属性强弱:K>Mg>Ca | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:LiOH>NaOH>KOH? |
2.如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )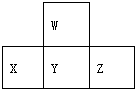

| A. | 元素X的最高价氧化物对应水化物的化学式为H3PO4 | |
| B. | 元素Y有2种氧化物且都能与元素W的氢化物反应生成对应价态的酸 | |
| C. | X、Y、Z各元素最高价和最低价的绝对值之和为8 | |
| D. | 原子半径的大小顺序是Z>Y>X>W |
9.下列说法中,正确的是( )
| A. | 1 mol H2SO4与1 molBa(OH)2反应生成H2O时放出的热叫做中和热 | |
| B. | △H>0 kJ•mol-1表示放热反应,△H<0 kJ•mol-1表示吸热反应 | |
| C. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
19.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+11.9kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在25℃,101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
6.常温避光条件下,下列各组气体能稳定共存的是( )
| A. | CH4 Cl2 H2 | B. | NO CO2 O2 | C. | NH3 N2 HCl | D. | H2S O2 SO2 |
3.下列不能由两种单质直接化合得到的物质是( )
| A. | FeCl3 | B. | CuCl2 | C. | FeS | D. | CuS |
4.按酸碱质子理论,下列粒子既可看作酸又可看作碱的是( )
| A. | CH3COO- | B. | NH4+ | C. | OH- | D. | HCO3- |