题目内容
19.铬是人体必需的一种微量元素,但是铬过量摄入对人体造成的危害非常大.目前对含铬废水的处理通常是将毒性较强的六价铬转化为毒性较弱的三价铬.某工业废水中含有一定量的Cr2O72-和CrO42-,处理方法之一为“还原沉淀法”,该法的工艺流程为:CrO${\;}_{4}^{2-}$$→_{H+①转化}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显橙色.
(2)能说明第①步反应达平衡状态的是C.
A.c(Cr2O72-)=c(CrO42-) B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-,需要6mol的FeSO4•7H2O.
分析 (1)根据2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O知,酸性条件下,平衡向正反应方向移动;
(2)当反应到达平衡状态时正逆反应速率相同、各物质的浓度保持不变;
(3)根据6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O计算.
解答 解:(1)根据2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O知,酸性条件下,平衡向正反应方向移动,所以若平衡体系的pH=2,该溶液是橙色;
故答案为:橙;
(2)A.Cr2O72-与CrO42-的浓度相同时正逆反应速率不一定相等,所以不一定是平衡状态,故A错误;
B.2v(Cr2O72-)=v(CrO42-)时正逆反应速率不一定相等,所以不一定是平衡状态,故B错误;
C.溶液的颜色不变,体系中各物质浓度不变,则该反应达到平衡状态,故C正确;
故答案为:C;
(3)第②步中,还原1mol Cr2O72-,发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,则消耗的FeSO4•7H2O为6mol;
故答案为:6.
点评 本题考查了化学平衡移动、平衡状态的判断、氧化还原反应的有关计算,题目难度不大,注意把握发生的反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.可逆反应 2A(s)+3B(g)?C(g)+2D(g)△H<0,在一定条件下达到平衡,下列有关叙述正确的是( )
| A. | 增加A的量,B的转化率提高 | |
| B. | 压强增大平衡不移动,v(正)、v(逆)均不变 | |
| C. | 增大B的浓度,v(正)>v(逆) | |
| D. | 升高温度,平衡向逆反应方向移动,v(正)减小 |
4.下列各组中互为同位素的是( )
| A. | D2O和H2O | B. | 235U和238U | C. | 红磷和白磷 | D. | SO2和SO3 |
8.美国天文学家在亚利桑那州一天文观察台探测到了银河系中心2.6万光年处一巨大气云中的特殊电磁波,这种电磁波表明那里可能有乙醇醛糖分子存在.下列有关乙醇醛糖(HOCH2CHO)的有关说法正确的( )
| A. | 乙醇醛糖是一种有机物,不易溶于水 | |
| B. | 乙醇醛糖能发生取代反应、加成反应、氧化反应以及还原反应 | |
| C. | 乙醇醛糖与甲酸乙酯互为同分异构体 | |
| D. | 1 mol 乙醇醛糖与足量的银氨溶液作用,可析出1 molAg |
9.准确配制一定物质的量浓度的NaOH溶液,下面实验操作中不正确的是( )
| A. | 用托盘天平称量时,应将NaOH固体放在小烧杯或玻璃器皿中 | |
| B. | 将烧杯中未冷却的NaOH溶液直接注入未经干燥的容量瓶中 | |
| C. | 定容时视线应平视凹液面(或平视刻度线),直到凹液面的最低点与刻度线相切 | |
| D. | 将称好的NaOH固体放入烧杯中,加入适量水溶解 |
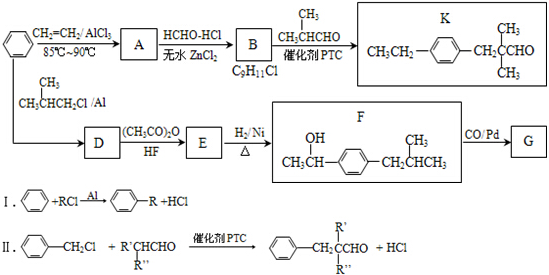
 .
.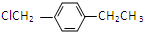 .
.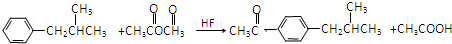 .
.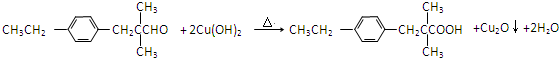
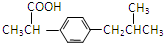 .
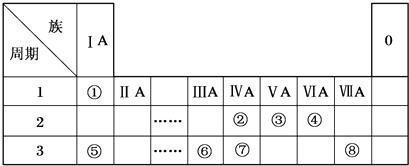
.
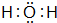 ,B的化学式NH3,C的离子符号NH4+
,B的化学式NH3,C的离子符号NH4+