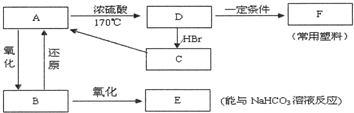
题目内容
11.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题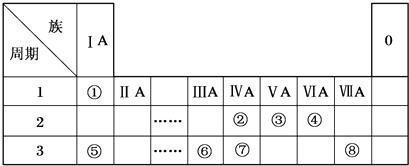
(1)②③④的原子半径由大到小的顺序是C>N>O.(用元素符号表示)
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3
(3)③④分别与①形成10个电子微粒A、B、C、D,其中A和B为分子,C为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D.则A的电子式
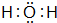 ,B的化学式NH3,C的离子符号NH4+
,B的化学式NH3,C的离子符号NH4+(4)⑤和⑥的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+H2O
(5)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,则反应的离子方程式为ClO-+2I-+H2O=Cl-+I2+2OH-.
分析 根据元素在周期表中的位置知,①~⑧分别是H、C、N、O、Na、Al、Si、Cl元素;
(1)同一周期元素,原子半径随着原子序数增大而减小;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(3)③④分别与①形成10个电子微粒A、B、C、D,其中A和B为分子,C为阳离子,D为阴离子,B溶于A后所得的物质可电离出C和D,则A是水、B是氨气、C是铵根离子、D是氢氧根离子;
(4)⑤和⑥的最高价氧化物对应的水化物分别是NaOH、Al(OH)3,二者发生反应生成偏铝酸钠和水;
(5)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,为NaClO,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,二者发生氧化还原反应生成碘和NaCl、KOH.
解答 解:根据元素在周期表中的位置知,①~⑧分别是H、C、N、O、Na、Al、Si、Cl元素;
(1)同一周期元素,原子半径随着原子序数增大而减小,所以原子半径C>N>O,故答案为:C>N>O;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>C>Si,所以其最高价氧化物的水化物酸性强弱酸性是HNO3>H2CO3>H2SiO3,
故答案为:HNO3>H2CO3>H2SiO3;
(3)③④分别与①形成10个电子微粒A、B、C、D,其中A和B为分子,C为阳离子,D为阴离子,B溶于A后所得的物质可电离出C和D,则A是水、B是氨气、C是铵根离子、D是氢氧根离子,所以A的电子式为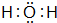 ,B的化学式为,C的离子符号为,故答案为:
,B的化学式为,C的离子符号为,故答案为: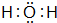 ;NH3;NH4+;
;NH3;NH4+;
(4)⑤和⑥的最高价氧化物对应的水化物分别是NaOH、Al(OH)3,二者发生反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+H2O,
故答案为:Al(OH)3+OH-=AlO2-+H2O;
(5)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,为NaClO,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,二者发生氧化还原反应生成碘和NaCl、KOH,离子方程式为ClO-+2I-+H2O=Cl-+I2+2OH-,
故答案为:ClO-+2I-+H2O=Cl-+I2+2OH-.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,涉及氧化还原反应、离子反应、元素周期律等知识点,知道常见10电子微粒,注意次氯酸盐的强氧化性,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 2,2-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-甲基-3-乙基丁烷 | D. | 4-甲基-3-乙基己烷 |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
| A. | HCl比H2S稳定 | B. | 常温下Cl2为气体,S单质为固体 | ||
| C. | 单质S可以在空气中燃烧Cl2不能 | D. | 溶于水时HCl是强酸而H2S是弱酸 |
| A. | 其分子空间结构类似三氯化氮 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 氯化硼分子呈平面三角形,属非极性分子 | |
| D. | 氯化硼液态时能导电而固态时不导电 |