题目内容
4.下列各组中互为同位素的是( )| A. | D2O和H2O | B. | 235U和238U | C. | 红磷和白磷 | D. | SO2和SO3 |
分析 质子数相同中子数不同的原子互称同位素,研究对象为原子,同种元素的不同种单质互为同素异形体.
解答 解:A、D2O与H2O都是由氢氧元素组成的,不同水分子,结构相同,为同一物质,故A错误.
B、两者都是铀元素的不同原子,互为同位素,故B正确;
C、两者均为P元素形成的不同种单质,互为同素异形体,故C错误;
D、两者均为S元素和O元素形成的不同种化合物,不是同位素,故D错误,故选B.
点评 本题以同位素为载体,考查化学“五同”比较,难度不大,注意把握概念的理解,水和重水是不同水分子,但结构相同,为同一物质.

练习册系列答案
相关题目
14.H、C、N、O、都属于自然界中常见非金属元素.
(1)O、C、N三种元素的第一电离能由小到大顺序是C O N;NH4+中氮原子轨道的杂化类型为sp3杂化.
(2)CO、N2的结构可表示为:C≡O、N≡N两者的键能数据:(单位kJ/mol)
结合数据说明CO比N2活泼的原因CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂.
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键.
(4)C、N元素形成的新材料具有如右图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料.该物质的化学式为:C3N4.
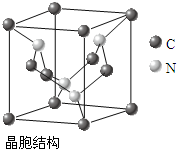
(1)O、C、N三种元素的第一电离能由小到大顺序是C O N;NH4+中氮原子轨道的杂化类型为sp3杂化.
(2)CO、N2的结构可表示为:C≡O、N≡N两者的键能数据:(单位kJ/mol)
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键.
(4)C、N元素形成的新材料具有如右图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料.该物质的化学式为:C3N4.

15.CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,在其他条件不变的情况下( )
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 反应物总能量小于生成物总能量 | |
| C. | 升高温度,反应速率加快,但反应的△H不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
9.下列电子式正确的是( )
| A. | 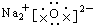 | B. | 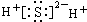 | ||
| C. | 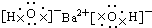 | D. |  |
16.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
| A. | 其分子空间结构类似三氯化氮 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 氯化硼分子呈平面三角形,属非极性分子 | |
| D. | 氯化硼液态时能导电而固态时不导电 |
13.19世纪中叶,门捷列夫的突出贡献是( )
| A. | 发现元素周期律 | B. | 提出分子学说 | C. | 提出原子学说 | D. | 提出电离学说 |
14.下列化学用语正确的是( )
| A. | 硫的原子结构示意图: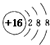 | |
| B. | NH4Br的电子式: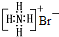 | |
| C. | Be2+离子中的质子数和电子数之比为2:1 | |
| D. | 中子数为146、原子序数为92的铀(U)原子:${\;}_{92}^{146}$U |
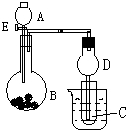 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中: