题目内容
1.在常温下进行下列实验,有关图象与对应叙述相符的是( )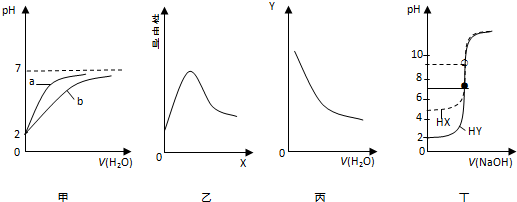
| A. | 图甲表示pH均为2的盐酸和醋酸分别用水稀释时pH变化曲线,其中a为醋酸 | |
| B. | 图乙表示0.1 mol•L-1 醋酸中加入X后溶液导电性曲线,则X可能是0.1 mol•L-1 氨水 | |
| C. | 图丙表示0.1 mol•L-1 氨水不断用水稀释曲线,Y可能是c(OH-) | |
| D. | 图丁表示0.0100 mol•L-1 NaOH溶液分别滴定20.00 mL 浓度均为0.0100 mol•L-1HX和HY的滴定曲线,可判断HX酸性比HY强 |
分析 A.用水稀释pH相同的盐酸和醋酸,盐酸的pH变化较大,醋酸的pH变化小;
B.醋酸中加氨水生成强电解质醋酸铵,溶液的导电性增强;
C.氨水加水稀释溶液的浓度减小,氢氧根离子浓度减小;
D.根据滴定前溶液中氢离子浓度与酸的浓度关系判断.
解答 解:A.用水稀释pH相同的盐酸和醋酸,加水稀释促进醋酸的电离,所以醋酸的pH变化小,而盐酸的pH变化较大,则图中a为盐酸,故A错误;
B.0.1 mol•L-1 醋酸中加入0.1 mol•L-1 氨水,二者反应生成强电解质醋酸铵,溶液的导电性增强,当氨水过量时继续加氨水,溶液的导电性又减弱,故B正确;
C.氨水加水稀释溶液的浓度减小,氢氧根离子浓度减小,所以图丙表示0.1 mol•L-1 氨水不断用水稀释曲线,Y可能是c(OH-),故C正确;
D.由图象可知,0.0100 mol•L-1HY其pH为2,即氢离子浓度为0.0100 mol•L-1,说明HY完全电离为强酸,0.0100 mol•L-1HX的pH为5,则XH为弱酸,故D错误.
故选BC.
点评 本题综合考查学生弱电解质的电离平衡、酸的稀释以及导电性的判断等方面的知识,属于综合知识的考查,难度中等,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
相关题目
10.某学生对SO2与漂粉精的反应进行实验探究:
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(2)pH试纸颜色的变化说明漂粉精溶液具有的化学性质是碱性;漂白性.
(3)用离子方程式解释现象ⅲ中黄绿色褪去的原因Cl2+SO2+2H2O=4H++2Cl-+SO42-.
| 操 作 | 现 象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
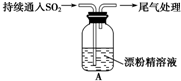 | ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的化学性质是碱性;漂白性.
(3)用离子方程式解释现象ⅲ中黄绿色褪去的原因Cl2+SO2+2H2O=4H++2Cl-+SO42-.
9.下列各项正确的是( )
| 电极反应式 | 出现环境 | |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═O2↑+2H2O | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | 2H2O+2e-═H2↑+2OH- | 用Cu作电极电解NaOH溶液的阴极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
16.下列物质性质与应用对应关系不正确的是( )
| A. | 汽油与水互不相溶,可用裂化汽油萃取溴水中的溴 | |
| B. | 明矾能水解生成氢氧化铝胶体,可用作水的净化剂 | |
| C. | Na2CO3溶液具有碱性,可用热的浓Na2CO3溶液洗涤试管内壁的油污 | |
| D. | Mg(OH)2受热分解生成H2O和MgO且△H>0,可用Mg(OH)2作阻燃剂 |
6.能用一种试剂鉴别乙醛、乙酸、甲酸、苯、四氯化碳的是( )
| A. | 银氨溶液 | B. | 新制Cu(OH)2 | C. | FeCl3 | D. | 溴水 |
10.下列说法中,错误的是( )
| A. | 元素周期表共18列 | B. | 氧元素位于第二周期ⅥA族 | ||
| C. | 金属最外层电子数均少于4 | D. | 氢是原子半径最小的元素 |
11.下列说法错误的是( )
| A. | 乙醇的水溶液可使蛋白质发生性质改变 | |
| B. | 纤维素在一定条件下水解生成葡萄糖 | |
| C. | 在一定条件下油脂水解可生成甘油 | |
| D. | 煤的干馏、石油的分馏都属于化学变化 |
 如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题:
如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题: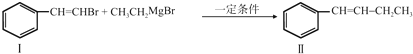
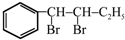 .
. ;(注明反应条件)
;(注明反应条件)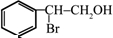 ,Ⅴ的结构简式为
,Ⅴ的结构简式为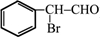 .
.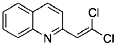 与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为
与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为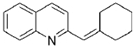 .
.