题目内容
10.下列说法中,错误的是( )| A. | 元素周期表共18列 | B. | 氧元素位于第二周期ⅥA族 | ||
| C. | 金属最外层电子数均少于4 | D. | 氢是原子半径最小的元素 |
分析 A、元素周期表共18列,16个族;
B、根据周期数等于电子层数,族序数等于最外层电子数;
C、锗、铋最外层电子数分别为4和5;
D、氢原子只有一个电子层.
解答 解:A、元素周期表共18列,16个族,其中第ⅤⅢ族是8、9、10三列,故A正确;
B、氧是8号元素,两个电子层,最外层6个电子,根据周期数等于电子层数,族序数等于最外层电子数,所以氧元素位于第二周期ⅥA族,故B正确;
C、锗、铋最外层电子数分别为4和5,大于等于4是金属,故C错误;
D、氢原子只有一个电子层,所以氢是原子半径 最小的元素,故D正确;
故选C.
点评 本题考查元素周期表与元素周期律的应用,题目较为简单,注意基础知识的积累.

练习册系列答案
相关题目
19. 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg;
(2)甲同学的实验目的是探究金属(反应物)本身的性质与反应速率的关系;要得出正确的实验结论,还需要控制的实验条件是温度相同.
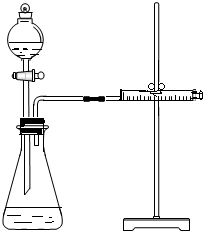
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②分别投入大小、形状相同的Cu、Fe、Mg | 反应速率Mg>Fe,Cu反应最慢 | 金属性质越活泼,反应 速率越快 |
(2)甲同学的实验目的是探究金属(反应物)本身的性质与反应速率的关系;要得出正确的实验结论,还需要控制的实验条件是温度相同.
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
1.在常温下进行下列实验,有关图象与对应叙述相符的是( )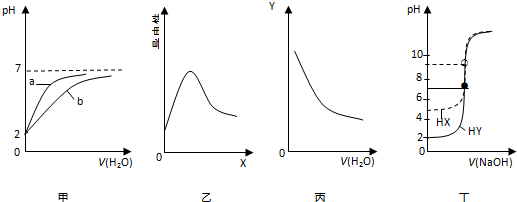

| A. | 图甲表示pH均为2的盐酸和醋酸分别用水稀释时pH变化曲线,其中a为醋酸 | |
| B. | 图乙表示0.1 mol•L-1 醋酸中加入X后溶液导电性曲线,则X可能是0.1 mol•L-1 氨水 | |
| C. | 图丙表示0.1 mol•L-1 氨水不断用水稀释曲线,Y可能是c(OH-) | |
| D. | 图丁表示0.0100 mol•L-1 NaOH溶液分别滴定20.00 mL 浓度均为0.0100 mol•L-1HX和HY的滴定曲线,可判断HX酸性比HY强 |
18.以下关于元素周期表的叙述正确的是( )
| A. | 元素周期表有七个主族,八个副族 | |
| B. | 每个短周期都有8种元素,每个长周期中都有18种元素 | |
| C. | 第三主族位于元素周期表的第三列(从左往右) | |
| D. | 零族位于元素周期表的第18列(从左往右) |
15.热化学方程式中的物质必须要注明聚集状态,原因是( )
| A. | 能描述出反应发生的状态 | B. | 说明反应条件 | ||
| C. | 为了区别一般的化学方程式 | D. | 物质呈现的状态与反应热有关 |
2.溶液中常见离子的检验及结论正确的是( )
| A. | 取样,若加入淀粉溶液,溶液显蓝色,则一定有I- | |
| B. | 取样,若加入AgNO3溶液由白色沉淀,则一定有Cl- | |
| C. | 取样,若加入BaCl2溶液,有白色沉淀产生,则一定有SO42- | |
| D. | 取样,若加入NaOH溶液,微热,产生使湿润红色石蕊试纸变蓝的气体,则一定有NH4+ |
19.下列化学用语与环境污染无关的是( )
| A. | 臭氧空洞 | B. | 酸雨 | C. | 赤潮 | D. | 潮汐 |
20.有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱溶液中发生反应的X的同分异构体有(不考虑立体异构)( )
| A. | 15种 | B. | 13种 | C. | 11种 | D. | 9种 |