题目内容
10.某学生对SO2与漂粉精的反应进行实验探究:| 操 作 | 现 象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
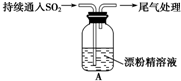 | ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的化学性质是碱性;漂白性.
(3)用离子方程式解释现象ⅲ中黄绿色褪去的原因Cl2+SO2+2H2O=4H++2Cl-+SO42-.
分析 (1)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;
(2)漂粉精溶液pH=12说明溶液呈碱性;后褪色,说明具有漂白性;
(3)氯气具有强氧化性,二氧化硫具有还原性,二者在水溶液中发生氧化还原反应.
解答 解:(1)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)漂粉精溶液pH=12>7,说明溶液呈碱性;后褪色,说明具有漂白性,
故答案为:碱性;漂白性;
(3)氯气具有强氧化性,二氧化硫具有还原性,二者在水溶液中发生氧化还原反应生成没有漂白性的盐酸盒硫酸,离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-,故答案为:Cl2+SO2+2H2O=4H++2Cl-+SO42-.
点评 本题考查二氧化硫的性质,二氧化硫是酸性氧化物,具有还原性、氧化性和漂白性,注意:氯气和二氧化硫以1:1混合通入水溶液中没有漂白性,为易错点.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
20.如图所示Cu-Zn原电池,下列叙述正确的是( )
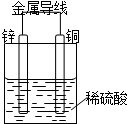

| A. | 锌为负极,发生氧化反应 | B. | 铜为负极,铜片上有气泡产生 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 溶液中的SO42-移向正极 |
1.试剂B、C分别是( )
| A. | NaOH、CuSO4 | B. | NaOH、新制Cu(OH)2 | C. | Na2CO3、CuSO4 | D. | H2SO4、新制Cu(OH)2 |
18.下列有关问题,与盐的水解无关的是( )
| A. | 用盐酸除铁锈 | |
| B. | 用纯碱溶液清洗油污 | |
| C. | 加热蒸干AlCl3溶液得到Al(OH)3固体 | |
| D. | 实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
5.如图是某可逆反应在反应过程中的各物质的物质的量(v)与时间(t)的关系曲线.下列叙述正确的是( )
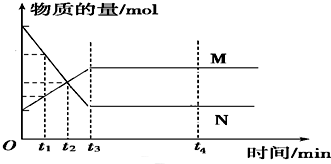

| A. | t1~t2时,只有正方向反应 | B. | t3~t4,反应不再发生 | ||
| C. | t3时,反应达到平衡 | D. | t3~t4,各物质的浓度相等 |
15.下列各组顺序的排列不正确的是( )
| A. | 酸性强弱:HClO4>H2SO4>H3PO4 | B. | 离子半径:Na+>Mg2+>Al3+>F- | ||
| C. | 热稳定性:HCl>H2S>PH3>SiH4 | D. | 氧化性:K+<Na+<Mg2+<Al3+ |
2.下列关于有机物的说法正确是( )
| A. | 乙烯、氯乙烯都属于不饱和烃 | |
| B. | 油脂、葡萄糖都能发生水解反应 | |
| C. | 乙酸、乙酸乙酯都不能与金属Na反应 | |
| D. | 苯能发生加成反应 |
19. 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg;
(2)甲同学的实验目的是探究金属(反应物)本身的性质与反应速率的关系;要得出正确的实验结论,还需要控制的实验条件是温度相同.
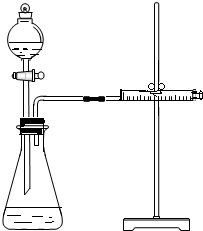
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②分别投入大小、形状相同的Cu、Fe、Mg | 反应速率Mg>Fe,Cu反应最慢 | 金属性质越活泼,反应 速率越快 |
(2)甲同学的实验目的是探究金属(反应物)本身的性质与反应速率的关系;要得出正确的实验结论,还需要控制的实验条件是温度相同.
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
1.在常温下进行下列实验,有关图象与对应叙述相符的是( )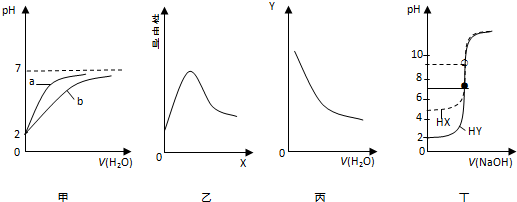

| A. | 图甲表示pH均为2的盐酸和醋酸分别用水稀释时pH变化曲线,其中a为醋酸 | |
| B. | 图乙表示0.1 mol•L-1 醋酸中加入X后溶液导电性曲线,则X可能是0.1 mol•L-1 氨水 | |
| C. | 图丙表示0.1 mol•L-1 氨水不断用水稀释曲线,Y可能是c(OH-) | |
| D. | 图丁表示0.0100 mol•L-1 NaOH溶液分别滴定20.00 mL 浓度均为0.0100 mol•L-1HX和HY的滴定曲线,可判断HX酸性比HY强 |