题目内容
19.国家对食品、空气、药品安全问题越来越重视,下列说法中一定正确的是( )| A. | 欧洲和北美洲的一些大城市上空二氧化氮浓度很高,其原因是这些地区硝酸工业发达 | |
| B. | 大气污染物中的二氧化硫能引起呼吸道疾病 | |
| C. | 天然的药物无任何毒副作用,可长期服用 | |
| D. | 长期食用二氧化硫含量超标的食品会破坏维生素B1,可通过服入碱性物质(如NaOH)的方法来消除二氧化硫中毒 |
分析 A.汽车尾气中含有大量的一氧化氮,一氧化氮容易氧化为二氧化氮;
B.二氧化硫有毒;
C.安全用药是指根据病情需要,正确选择药物的品种、剂量和服用时间等,以充分发最佳效果,尽量避免药物对人体产生的不良作用或危害;
D.强氧化钠为强碱,具有腐蚀性.
解答 解:A.欧洲和北美洲的一些大城市上空二氧化氮浓度很高,与汽车过多有很大关系,故A错误;
B.大气污染物中的二氧化硫有毒,吸入体内能引起呼吸道疾病,故B正确;
C.“是药三分毒”天然药物也有副作用的,不能过量服用,故C错误;
D.NaOH的碱性太强,腐蚀性强,则不能服入NaOH的方法来消除二氧化硫中毒,可选择弱碱性溶液,如碳酸钠、肥皂水等,故D错误;
故选:B.
点评 本题考查了与生产生活相关的化学,熟悉二氧化硫、氮的氧化物等有毒物质的性质及生活中用药的安全常识是解题关键,注意对相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列递变情况中,正确的是( )
| A. | Si、P、S元素的最高正价依次降低 | |
| B. | Li、Na、K的原子半径依次增大 | |
| C. | C、O、N的原子半径依次减小 | |
| D. | Na、Mg、Al原子的最外层电子数依次减少 |
10.以CaCO3、海水等为原料,可以制备一系列物质,如图所示.下列说法正确的是( )
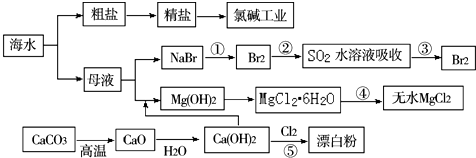

| A. | Cl2、漂白粉和SO2均可以漂白有色物质,且漂白的原理相同 | |
| B. | 氯碱工业就是指工业上电解饱和食盐水的方法制取NaOH、Cl2、H2的过程 | |
| C. | 工段④必须在干燥的HCl气流中加热才能制取无水MgCl2 | |
| D. | 工段①②③发生的反应均为氧化还原反应,且溴元素均被氧化 |
7.如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
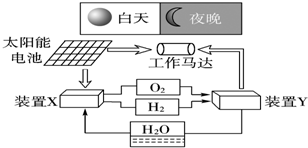

| A. | 二氧化硅是太阳能电池的光电转换材料 | |
| B. | 装置X能实现燃料电池的氢气和氧气再生 | |
| C. | 装置Y中负极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
14.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
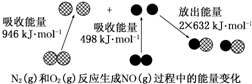
下列说法正确的是( )

下列说法正确的是( )
| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO(g) | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
11.下列有关物质的性质与应用对应关系不正确的是( )
| A. | 常温下,铁与浓硝酸发生钝化,常用铁罐车运输浓硝酸 | |
| B. | SO2有漂白性,常用它来漂白纸浆 | |
| C. | 硅酸钠溶液呈碱性,常用做木材的防火剂 | |
| D. | Al具有良好的延展性和抗腐蚀性,常用铝箔包装物品 |
8.一定量Na2O2和NaHCO3,均匀混合物分成质量相等的甲乙两份.将甲投入100ml稀盐酸,固体完全溶解,收集到标准状况下干燥气体2.24L.再将生成气体全部导入装有乙的干燥管中,充分吸收后,收集到一种单质气体,标准状况下体积为2.016L.根据以上信息,下列有关推断不正确的是( )
| A. | 甲乙两份混合物中均含Na2O20.16mol | |
| B. | 甲乙两份混合物中均含NaHCO30.02mol | |
| C. | 原混合物中Na2O2与NaHCO3物质的量之比无法确定 | |
| D. | 盐酸物质的量浓度可能为3.4mol/L |
9.下列说法正确的是( )
| A. | 油脂的氢化是指将不饱和程度较高、熔点较低的液态油,通过催化加氢,可提高饱和度,转化成半固态的脂肪的过程 | |
| B. | 在酸性条件下,蔗糖水解成葡萄糖和果糖,它们都能被溴水氧化 | |
| C. | 氨基酸是两性化合物,只有两个不同氨基酸分子间脱水才能形成肽键 | |
| D. | 蛋白质遇到醋酸铅变性沉淀,加入大量的水,沉淀还可溶解 |