题目内容
11.下列有关物质的性质与应用对应关系不正确的是( )| A. | 常温下,铁与浓硝酸发生钝化,常用铁罐车运输浓硝酸 | |
| B. | SO2有漂白性,常用它来漂白纸浆 | |
| C. | 硅酸钠溶液呈碱性,常用做木材的防火剂 | |
| D. | Al具有良好的延展性和抗腐蚀性,常用铝箔包装物品 |
分析 A、常温下浓硝酸与铁发生钝化反应,表面形成致密的氧化膜;
B、二氧化硫具有漂白性,其漂白原理是能和某些有色物质反应生成无色物质;
C、硅酸钠不燃烧也不支持燃烧,可以作防火剂;
D、Al具有良好的延展性和抗腐蚀性,可制成铝箔,且在表面能生成一层致密的氧化物膜.
解答 解:A.常温下浓硝酸与铁发生钝化反应,而不是不反应,在表面生成一层致密的氧化物膜,可阻碍反应的继续进行,故A正确;
B、二氧化硫具有漂白性,其漂白原理是能和某些有色物质反应生成无色物质,故利用二氧化硫漂白纸浆正确,故B正确;
C、硅酸钠不燃烧也不支持燃烧,可以作防火剂,与硅酸钠溶液的碱性无关,故C错误;
D、Al具有良好的延展性,可制成铝箔,且在表面能生成一层致密的氧化物膜,则具有抗腐蚀性,可制成铝箔包装物品,故D正确;
故选C.
点评 本题考查物质的用途,明确物质的性质是解本题关键,性质决定用途,用途体现性质,会运用化学知识解释生产生活现象,题目难度不大.

练习册系列答案
相关题目
1.已知:弱酸HX(aq)与NaOH(aq)反应的中和热△H=-12.1kJ•mol-1; HCl(aq)与NaOH(aq)反应的中和热△H=-55.6kJ•mol-1.则HX在水溶液中电离的△H 等于( )
| A. | +43.5 | B. | -43.5 | ||
| C. | -67.7 | D. | +67.7(单位:kJ•mol-1) |
19.国家对食品、空气、药品安全问题越来越重视,下列说法中一定正确的是( )
| A. | 欧洲和北美洲的一些大城市上空二氧化氮浓度很高,其原因是这些地区硝酸工业发达 | |
| B. | 大气污染物中的二氧化硫能引起呼吸道疾病 | |
| C. | 天然的药物无任何毒副作用,可长期服用 | |
| D. | 长期食用二氧化硫含量超标的食品会破坏维生素B1,可通过服入碱性物质(如NaOH)的方法来消除二氧化硫中毒 |
6.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是( )
| 选项 | 化学反应 | 离子方程式 | 评价 |
| A | NaClO溶液中通入过量SO2气体 | ClO-+H2O+SO2═HClO+HSO3- | 正确 |
| B | NH4HSO3溶液中加入等量NaOH | HSO3-+OH-═SO32-+H2O | 错误,OH-能同时与NH4+、HSO3-反应 |
| C | Na2CO3 的水解 | CO32-+H2O?CO2↑+2OH- | 错误,水解反应不加气体符号 |
| D | 用稀硝酸清洗做过银镜反应的试管 | Ag+4H++NO3-═Ag++NO↑+2H2O | 错误,等式两端电荷不守恒 |
| A. | A | B. | B | C. | C | D. | D |
16.下列指定反应的离子方程式正确的是( )
| A. | 向烧碱溶液中加入铝:Al+2OH-=AlO2-+H2↑ | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O | |
| C. | 将饱和FeCl3溶液滴入废水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ | |
| D. | 用Fe2+将饮用水中少量ClO2-还原成为Cl-:4Fe2++ClO2-+4H+=4Fe3++Cl-+2H2O |
3.生活中碰到的某些问题,常涉及到化学知识,下列说法正确的是( )
| A. | 塑料奶瓶比玻璃奶瓶更有利于健康,且更加经久耐用 | |
| B. | 含乙醇、NaClO、H2O2等消毒液均可以将病毒氧化而达到消毒目的 | |
| C. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 | |
| D. | 碳酸铝是一种应用很广的食品添加剂,可大量添加到馒头、面包等食品中 |
1.下列离子方程式正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 向硫酸氢钠溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| D. | 硫氢根离子的电离方程式:HS-+H2O?H3O++S2- |
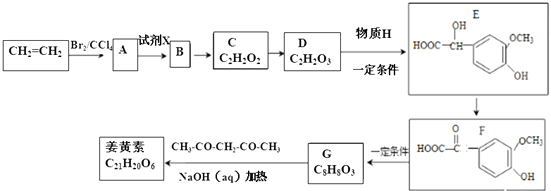
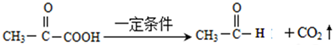

 .
.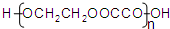 .
.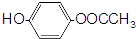 .
.