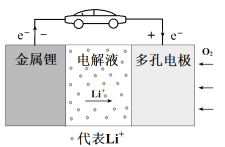
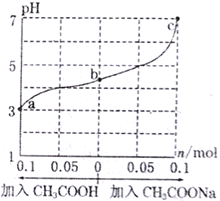
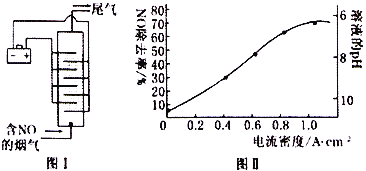
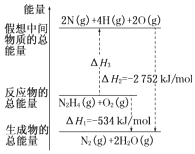
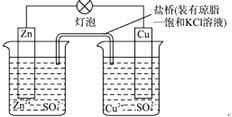
��Ŀ����
����Ŀ��������Ӧ���������칤���������Ѿ��������ҹ��Ŵ���¯��ʯ����Ҫ�ɷ�ZnCO3����úұп���գ�п����Ҫ��;������п�Ͻ����Ϊ���������ı����㡣�ش�����������
��1��Znԭ�ӻ�̬��������Ų�ʽΪ_____________________________��
��2������п���ڰ�ˮ�γ�[Zn(NH3)4]SO4��Һ��
����SO42-��Ϊ�ȵ�����������ӻ�ѧʽΪ________________��д��һ����
���������ȶ���ǿ���(PH3)��ԭ����____________________________��
��3����ͭ����ͭ��п����ɵĺϽ�Ԫ��ͭ��п�ĵ�һ�����ֱܷ�ΪICu=746 kJ��mol-1��IZn=906 kJ��mol-1��ICu< IZn��ԭ����___________________��
��4�������ݸ�Ŀ���м���¯��ʯ����Ҫ�ɷ�ZnCO3����ֹѪ����������������Ŀ������Zn��C��O�縺���ɴ���С��˳����_________________��ZnCO3�������ӵ����幹����_____________________��
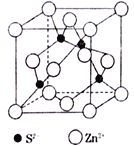
��5��ZnS��ӫ���塢�����ϡ�Ϳ�ϡ����ϵ���ҵ��Ӧ�ù㷺������ZnS�����ṹ��ͼ��ʾ��ÿ��Znԭ����Χ�����Znԭ����ĿΪ________________�������߳�Ϊapm�������ӵ�������ֵΪNA����ZnS������ܶ�Ϊ __________g��cm-3���г�����ʽ��������
���𰸡� 1s22s22p63s23p63d104s2��[Ar]3d104s2 PO43-(��ClO4-) ��Ԫ�صķǽ�����ǿ����Ԫ�� пʧȥ����ȫ������4s2���ӣ�ͭʧȥ����4s1���� O>C>Zn ƽ�������� 12 97��4/(a��10-10)3NA
����������1��Zn��30��Ԫ�أ���ԭ�ӻ�̬��������Ų�ʽΪ1s22s22p63s23p63d104s2��[Ar]3d104s2��
��2������SO42-��Ϊ�ȵ��������������PO43-(��ClO4-) ���ڰ������ȶ���ǿ���(PH3)��ԭ���ǵ�Ԫ�صķǽ�����ǿ����Ԫ����
��3��Ԫ��ͭ��п�ĵ�һ�����ֱܷ�ΪICu=746 kJ��mol-1��IZn=906 kJ��mol-1��ICu< IZn��ԭ����пʧȥ����ȫ������4s2���ӣ�ͭʧȥ����4s1������
��4��ͨ���ǽ�����Խǿ��Ԫ����縺��Խ��Zn��C��O�縺���ɴ���С��˳����O>C>Zn��ZnCO3��������CO32-������ԭ��C���ӻ���ʽ��sp2��C��3��O�γ�����������CO32-�����幹����ƽ����������
��5��������ZnS�����ṹʾ��ͼ��֪���þ�������4��Znԭ�Ӻ�4��Sԭ����ÿ��Znԭ����Χ�����Znԭ����λ�ھ����Ķ���������ϵ�Znԭ�ӣ�ÿ���������ڽ���3���������������ÿ��Znԭ����Χ�����Znԭ����ĿΪ![]() 12�������߳�Ϊapm�������ӵ�������ֵΪNA����NA������������������ֱ���
12�������߳�Ϊapm�������ӵ�������ֵΪNA����NA������������������ֱ���![]() ��NA (a��10-10)3 cm3�����ԣ�ZnS������ܶ�Ϊ 97��4/(a��10-10)3NAg��cm-3��
��NA (a��10-10)3 cm3�����ԣ�ZnS������ܶ�Ϊ 97��4/(a��10-10)3NAg��cm-3��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ���������ʵķ�����ȷ���ǣ� ��
�� | �� | �� | ���������� | ���������� | |
A | Na2CO3 | H2SO4 | BaCO3 | MgO | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaCl2 | CO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A.A
B.B
C.C
D.D