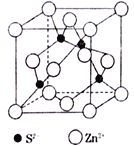
题目内容
【题目】铜锌原电池(如图)工作时,以下说法正确的是( ) ①电子流动方向从Zn﹣灯泡﹣Cu﹣盐桥;②Zn电极的质量减轻Cu电极的质量增重;③盐桥中的K+移向CuSO4溶液;④将锌片浸入硫酸铜溶液发生的化学反应与该电池反应相同为:Zn+Cu2+═Zn2++Cu;⑤Zn电极失电子发生还原反应.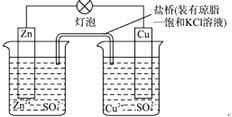
A.①②③
B.②④⑤
C.②③④
D.③④⑤
【答案】C
【解析】解:①从负极沿导线流向正极,电子流动方向从Zn﹣灯泡﹣Cu,电子不能经过溶液,故错误;
②锌失电子,则Zn电极的质量减轻,Cu电极上铜离子得电子生成Cu,则Cu电极的质量增重,故正确;
③溶液中阳离子向正极移动,则盐桥中的K+移向CuSO4溶液,故正确;
④将锌片浸入硫酸铜溶液,Zn与铜离子发生置换反应,发生的化学反应与该电池反应相同为:Zn+Cu2+═Zn2++Cu,故正确;
⑤Zn电极失电子发生氧化反应,故错误.
故选C.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目