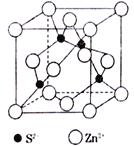
题目内容
【题目】下图中甲和乙均是盐桥原电池装置。请按要求填空

(1)甲中Co电极发生的反应方程式为_____________________________________。
(2)两烧杯中盐桥(填充物为浸有饱和KNO3溶液的琼脂)的作用是__________并使两烧杯中溶液保持电中性。
(3)判断反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能否自发进行并解释理由_________________________。
(4)开始时,乙电池左右烧杯各含100溶液,且Co2+、Ag+浓度均为4mol/L,当有1.204×1022个电子通过外电路时,两烧杯溶液中Co2+、Ag+浓度差为__________(忽略溶液的体积变化)。
【答案】 Co2++2e-=Co 将两个烧杯组成的内电路连接起来形成闭合回路 不能,因为由甲乙两图可知,还原性Cd>Ag,因此该反应不能自发进行 0.3mol/L
【解析】甲图中,Cd作负极,负极上失电子发生氧化反应,Co作正极,正极上溶液中金属阳离子得电子发生还原反应生成金属单质;乙图中,Co作负极,负极上失电子发生氧化反应,Ag作正极,正极上银离子得电子发生还原反应生成银单质,据此解答。
(1)根据装置图可判断甲中Co电极是正极,溶液中的Co2+发生得到电子的还原反应,即发生的反应方程式为Co2++2e-=Co。
(2)原电池放电时,负极上失去电子,正极上得电子,电子从负极沿导线流向正极,如果没有盐桥,不能形成闭合回路,没有电流产生,所以盐挢的作用是将两个烧杯组成的内电路连接起来形成闭合回路,并使两边溶液保持电中性。
(3)根据甲乙两图可知,还原性Cd>Ag,因此该反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)不能自发进行。
(4)1.204×1022个电子的物质的量是1.204×1022/6.02×1023mol-1=0.02mol,则Co2+浓度增加0.1mol/L,Ag+浓度减少0.2mol/L,所以两烧杯溶液中Co2+、Ag+浓度差为0.3mol/L。

 阅读快车系列答案
阅读快车系列答案