题目内容
【题目】锂-空气电池的工作原理如图所示。其中多孔电极材料选用纳米多孔金时, 该电池表现出良好的循环性能。电池反应为: 2Li+O2=Li2O2。 下列说法错误
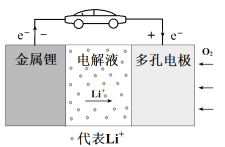
A. 该电池的电解液常用锂盐的有机溶液
B. 电池工作时,外电路中流过 0.01 mol 电子,负极材料减重 0.07g
C. 电池工作时,正极反应可能经过两个过程: Li++O2+e-=LiO2 Li++LiO2+e-=Li2O2
D. 电池充电时间越长,电池中 Li2O2越多
【答案】D
【解析】A、该电池的负极是Li,所以电解质溶液不能是水溶液,根据图示,锂离子定向移动,故电解液常用锂盐的有机溶液,故A正确;B、负极的电极反应为:Li-e- =Li+,外电路中流过 0.01 mol 电子,即有1mol Li反应,负极材料减重 0.07g,故B正确;C、根据总反应Li最终转化成了Li2O2,所以正极可能先生成LiO2,再生成Li2O2,故正极反应可能经过两个过程: Li++O2+e-=LiO2 Li++LiO2+e-=Li2O2,故C正确;D、充电时的反应为:Li2O2=2Li+O2,电池充电时间越长,电池中 Li2O2越少,故D 错误;故选D。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:

有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)仪器a的名称是_____,装置A中发生反应的化学方程式为____________。
(2)B装置的作用除观察O2的流速之外。还有____________。
(3)C装置控制反应在60℃~65℃进行,其主要目的是____________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液40.00mL,使Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是_______(填标号),滴定終点的现象为_____________。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②C1元素的质量百分含量为(列出算式)____________。
③步骤III加入硝基苯的目的是___,如无此操作,所测C1元素含量将会___(填“偏大”“偏小”或“不变”)。