题目内容
【题目】全钒液流电池是一种新型的绿色环保储能电池,其电池总反应为:V3++VO2++H2O ![]() VO2++2H++V2+ . 下列说法正确的是( )
VO2++2H++V2+ . 下列说法正确的是( )
A.放电时正极反应为:VO2++2H++e﹣=VO2++H2O
B.放电时每转移2mol电子时,消耗1mol氧化剂
C.充电过程中电子由阳极经导线移向阴极,再由阴极经电解质溶液移向阳极
D.放电过程中,H+由正极移向负极
【答案】A
【解析】解:A、原电池放电时,VO2+离子化合价降低,被还原,应是电源的正极反应,生成VO2+离子,反应的方程式为VO2++2H++e﹣=VO2++H2O,故A正确;
B、放电时氧化剂为VO2+离子,在正极上被还原后生成VO2+离子,每转移2mol电子时,消耗2mol氧化剂,故B错误;
C、内电路由溶液中离子的定向移动形成闭合回路,电子不经过溶液,故C错误;
D、放电过程中,电解质溶液中阳离子向正极移动,阴离子向负极移动,故D错误.
故选A.

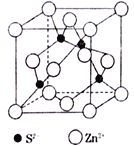
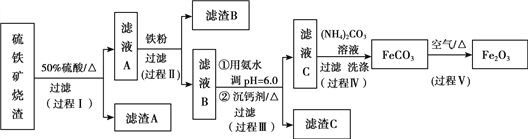
【题目】某课题组以硫铁矿烧渣(含Fe2O3、Fe3O4、Al2O3、CaO、SiO2等)为原料制取软磁用Fe2O3(要求纯度>99.2%,CaO含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
已知:生成氢氧化物的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)滤渣A的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。反应后,可以用__________溶液检验说明Fe3+是否已经完全反应。
(3)在过程Ⅱ中,课题组对滤液A稀释不同倍数后,加入等质量的过量铁粉,得出Fe3+浓度、还原率和反应时间的关系如图所示:
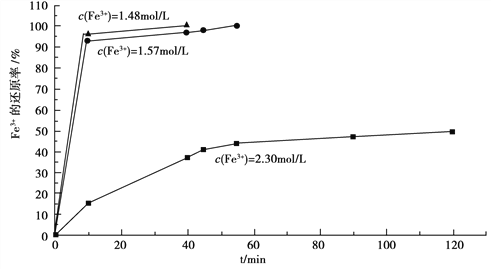
结合上述实验结果说明:课题组选择稀释后c(Fe3+)为1.60mol/L左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:
(已知:滤液B中钙的含量以CaO计为290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果,选择适宜的沉钙剂,得到滤渣C的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。