题目内容
【题目】根据要求回答问题:
(1)已知在常温常压下: ①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJmol﹣1
②H2O(l)═H2O(g)△H=+44.0kJmol﹣1
写出表示甲醇燃烧热的热化学方程式 .
(2)肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N﹣N为154,则断裂1mol N﹣H键所需的能量(kJ)是 . 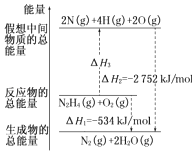
【答案】
(1)CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣725.8kJ?mol﹣1
O2(g)═CO2(g)+2H2O(l)△H=﹣725.8kJ?mol﹣1
(2)391
【解析】解:(1)表示甲醇的燃烧热的化学方程式,应是1mol甲醇反应,且生成二氧化碳和液态水,利用盖斯定律,将①× ![]() ﹣②×2可得甲醇燃烧热的热化学方程式为CH3OH(l)+
﹣②×2可得甲醇燃烧热的热化学方程式为CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣725.8kJmol﹣1,
O2(g)═CO2(g)+2H2O(l)△H=﹣725.8kJmol﹣1,
所以答案是:CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣725.8kJmol﹣1;(2)依据图象分析,反应为N2H4+O2=N2+2H2O,反应的焓变△H=﹣534KJ/mol,反应的焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,设断裂1molN﹣H键吸收的能量为x,断裂化学键吸收的能量=2752﹣534=2218,形成新键释放的能量=4x+154+500=2752﹣534,解得:x=391,
O2(g)═CO2(g)+2H2O(l)△H=﹣725.8kJmol﹣1;(2)依据图象分析,反应为N2H4+O2=N2+2H2O,反应的焓变△H=﹣534KJ/mol,反应的焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,设断裂1molN﹣H键吸收的能量为x,断裂化学键吸收的能量=2752﹣534=2218,形成新键释放的能量=4x+154+500=2752﹣534,解得:x=391,
所以答案是:391.

 举一反三期末百分冲刺卷系列答案
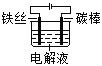
举一反三期末百分冲刺卷系列答案【题目】某化学小组以铁为阳极,探究不同条件下阳极发生的电极反应。
实验装置 | 实验 | 电压 | 电解液 | 实验现象 |
| ⅰ | 3V | 3mol/LNa2SO4溶液 | 碳棒表面有大量气泡产生,溶液变黄,有红褐色沉淀产生 |
ⅱ | 3V | 3 mol/L KI溶液 | 碳棒表面有大量气泡产生,铁丝附近溶液变为棕色,逐渐变为棕褐色,约5min后,棕褐色消失,逐渐产生灰绿色絮状物 | |
ⅲ | 3V | 3mol/L NaOH溶液 | 两电极上都有大量气泡产生,5min后停止实验,取出铁丝,铁丝明显受腐,附有红棕色固体,溶液中未见沉淀物。 |
(1)①实验ⅰ中碳棒表面产生的气体是__________。
②实验ⅲ中铁丝上生成气体的电极反应式为__________。
③在实验ⅱ中,为验证铁丝电极的产物,取少量铁丝附近棕色溶液于试管中,滴加2滴K3Fe(CN)6溶液,无明显变化;另取少量铁丝附近棕色溶液检验发现溶液中有I2,检验方法是__________;对比实验ⅰ、ⅱ、ⅲ,可得出的结论是__________。
(2)为进一步探究增大c(OH-)对阳极反应的影响,该小组利用原装置做了实验ⅳ。
实验 | 电压 | 电解液 | 实验现象 |
ⅳ | 3V | 10 mol/L NaOH溶液 | 两电极上都有大量气泡产生,但碳棒上的速率远大于铁丝,且阳极区溶液逐渐变紫红色;停止实验,铁丝明显变细,电解液仍然澄清 |
查阅资料:FeO42-在溶液中呈紫红色。阳极电极反应式是__________。
(3)为探究实验ⅰ中溶液变黄的原因,该小组利用原装置做了实验ⅴ和ⅵ。
实验 | 电压 | 电解液 | 实验现象 |
ⅴ | 3V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面有大量气泡产生,铁丝外围包裹一层白色絮状沉淀,2min后表层变为褐色。 |
ⅵ | 8V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面迅速产生大量气泡,铁丝表面有气泡,1min后外围包裹一层白色絮状沉淀,2min后变绿,溶液中有红褐色悬浮物。 |
①实验ⅵ中白色絮状沉淀变为红褐色的反应化学方程式是__________。
②由此确定实验ⅰ中溶液变黄的原因是__________。
(4)综合上述实验,当铁为阳极时,影响电解过程中的阳极电极产物的因素有__________。