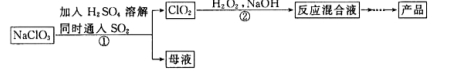
题目内容
【题目】黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:

回答下列问题:
(1)在FeS2中的S2-的核外电子排布式是________________________;
(2)常温下Fe3+比Fe2+要更加稳定的原因是__________________________________;
(3)将FeS2与稀盐酸反应得到H2S2,H2S2分子中,共价键的类型是___________________;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________ ,写出两个与SO2互为等电子体的分子或离子_______________________。-
(4)H2SO4和H2SO3都是S的含氧酸,请用结构知识解释H2SO4比H2SO3酸性强的原因:
_____________________________________________________________________。
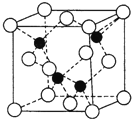
(5)FeS2的晶体中的Fe2+离子的排列方式如下图。
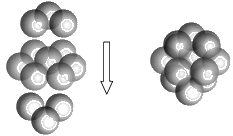
①每个Fe2+周围最近的等距离的S22-离子有____________个。
②已知FeS2的晶胞参数是a0=0.54nm,它的密度为_____________________g·cm-3(列式并计算,阿伏加德罗常数为6.02×1023)。
【答案】(1)1s22s22p63s23p6;(2)Fe3+的基态电子排布式为[Ar]3d5,价层电子是半满状态,个轨道电子均处于稳定状态,Fe2+的基态电子排布式为[Ar]3d6,3d轨道电子不是稳定状态,所以常温下Fe3+比Fe2+要更加稳定;(3)极性共价键和非极性共价键,sp2杂化,O3、NO2-;(4)H2SO4和H2SO3都是S的含氧酸,结构分别为 ,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强;(5)①6;②5.06.
,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强;(5)①6;②5.06.
【解析】
试题分析:(1)(1)在FeS2中的S2-的核外电子排布式是1s22s22p63s23p6,答案为:1s22s22p63s23p6;(2)Fe3+的基态电子排布式为[Ar]3d5,价层电子是半满状态,个轨道电子均处于稳定状态,Fe2+的基态电子排布式为[Ar]3d6,3d轨道电子不是稳定状态,所以常温下Fe3+比Fe2+要更加稳定,答案为:Fe3+的基态电子排布式为[Ar]3d5,价层电子是半满状态,个轨道电子均处于稳定状态,Fe2+的基态电子排布式为[Ar]3d6,3d轨道电子不是稳定状态,所以常温下Fe3+比Fe2+要更加稳定;(3)H2S2分子和过氧化氢分子互为等电子体,过氧化氢的电子式为![]() ,分子中含有极性共价键和非极性共价键,所以H2S2分子的共价键的类型极性共价键和非极性共价键,SO2分子中的S原子的价层电子对数为2+(6-2X2)/2=3,S原子杂化轨道类型是sp2杂化,SO2是三原子,18电子的分子,与O3和NO2-互为等电子体,答案为:极性共价键和非极性共价键,sp2杂化,O3、NO2-;(4)H2SO4和H2SO3都是S的含氧酸,结构分别为
,分子中含有极性共价键和非极性共价键,所以H2S2分子的共价键的类型极性共价键和非极性共价键,SO2分子中的S原子的价层电子对数为2+(6-2X2)/2=3,S原子杂化轨道类型是sp2杂化,SO2是三原子,18电子的分子,与O3和NO2-互为等电子体,答案为:极性共价键和非极性共价键,sp2杂化,O3、NO2-;(4)H2SO4和H2SO3都是S的含氧酸,结构分别为 ,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强,答案为:H2SO4和H2SO3都是S的含氧酸,结构分别为
,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强,答案为:H2SO4和H2SO3都是S的含氧酸,结构分别为 ,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强;(5)①每个Fe2+周围最近的等距离的S22-离子存在于面心,共有六个,答案为:6;②一个晶胞中含有Fe2+数目为
,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强;(5)①每个Fe2+周围最近的等距离的S22-离子存在于面心,共有六个,答案为:6;②一个晶胞中含有Fe2+数目为![]() ,含有S22-数目为
,含有S22-数目为![]() ,一个晶胞的质量为:
,一个晶胞的质量为:![]() ,一个晶胞的体积为
,一个晶胞的体积为![]() ,已知FeS2的晶胞参数是a0=0.54nm,它的密度为5.06g·cm-3,答案为:5.06.
,已知FeS2的晶胞参数是a0=0.54nm,它的密度为5.06g·cm-3,答案为:5.06.