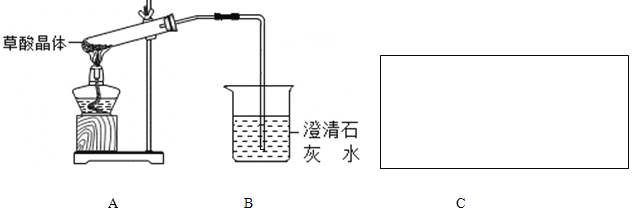
题目内容
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂和漂白剂,主要用于棉纺、纸浆漂白和鱼药的制造。制备亚氯酸钠的工艺流程如下:
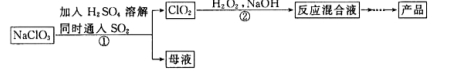
(1)要加快步骤①的反应速率,可采取的措施为 。(写一种即可)
(2)步骤①的离子方程式为 ,每生成标准状况下22.4L的ClO2,转移电子数为 。
(3)步骤②中H2O2的作用是 ;从“反应混合液”到“产品”的过程中先需蒸发溶剂,写出蒸发所需的硅酸盐仪器的名称 。
(4)NaClO2产品中通常混有少量NaCl。取样品wg,测得Na的物质的量为nmol,则该样品中NaClO2的物质的量为______mol。
【答案】(1)升高温度(或其它合理答案)(2分)
(2)2ClO3-+SO2=2ClO2+SO42- NA
(3)还原剂 酒精灯,蒸发皿,玻璃棒
(4)(w-58.5n)/32
【解析】
试题分析:在酸性条件下NaClO3与SO2发生反应①:2NaClO3+SO2=2ClO2+Na2SO4。母液中主要含有Na2SO4;ClO2气体与 H2O2、NaOH发生反应②:H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2。因为亚氯酸钠受热易分解,而物质的沸点随压强的增大而升高。所以采用低温、减压法蒸发溶剂,就会得到亚氯酸钠晶体。
(1)要加快步骤①的反应速率,可采取的措施有适当升高反应温度,增大吸收液浓度,增大SO2与吸收液的接触面积,通入更多的SO2等。
(2)反应①的离子方程式是2ClO3-+SO2=2ClO2+SO42-。标准状况下22.4L的ClO2的物质的量是1mol,反应中氯元素化合价从+5价降低到+4价,得到1个电子,则转移电子数为NA;
(3)反应②的方程式为 H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2,在反应中ClO2把H2O2氧化为O2,它本身被还原为NaClO2。因此该反应的的氧化剂是ClO2,双氧水是还原剂;蒸发所需的硅酸盐仪器有酒精灯,蒸发皿,玻璃棒;
(4)设样品中NaClO2的物质的量为xmol,氯化钠是ymol,则根据钠原子守恒可知x+y=n,根据质量守恒可知90.5x+58.5y=w,解得x=(w-58.5n)/32。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案