题目内容
【题目】已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3P轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体。根据以上信息,回答下列问题:

(1)A、B、C、D的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)化合物BD3的分子空间构型是 。
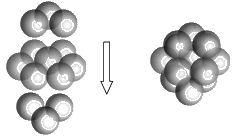
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为 。
②与同一个E原子相连的F原子构成的空间构型为 。
③下列说法正确的是 。
A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为 。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为 (写出计算过程)
【答案】(1)Na<S<P<Cl ;(2)三角锥形;(3)① 4 ;②正四面体 ;③BCD ④SP2 ; ⑤ ![]()
【解析】
试题分析:已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的,B只能是P元素。D原子得到一个电子后3P轨道全充满,D是Cl元素。A+比D原子形成的离子少一个电子层,A是Na元素。C与A形成A2C型离子化合物,C是S元素。E的原子序数为31,E是Ga,F与B属同一主族,E与F形成的化合物常用于制造半导体F是As元素。(1)A、B、C、D的第一电离能由小到大的顺序为Na<S<P<Cl,答案为:Na<S<P<Cl;(2)PCl3的价层电子对数为3+(5-3x1)/2=4,其中有一对孤电子,所以PCl3的空间构型为三角锥形,答案为:三角锥形;(3)①该晶胞中F原子位于顶点和面心,所包含的F原子(白色球)个数为8×![]() +6×
+6×![]() =4,答案为:4;②与同一个E原子相连的F原子个数为4,E原子的杂化方式为sp3杂化,所以与同一个E原子相连的F原子构成的空间构型为正四面体形,答案为:正四面体;③A.该晶胞结构与NaCl不相同,A错误;B.半导体EB与EF互为等电子体,B和F位于同一主族,价层电子数相同,所以它们属于等电子体,B正确;C.F和E同周期,但F的非金属性强于E,电负性:F>E,C正确;D.EF晶体属于原子晶体,原子间通过配位键相连,所以晶体中含有配位键,D正确,答案为:BCD;④(CH3)3E中E原子的价层电子对数为3+(3-3x1)=3,所以(CH3)3E中E原子杂化方式为sp2杂化,答案为:sp2;⑤设晶胞棱边的长度为a,晶体中紧邻的F原子之间的距离为面对角线的1/2,即为
=4,答案为:4;②与同一个E原子相连的F原子个数为4,E原子的杂化方式为sp3杂化,所以与同一个E原子相连的F原子构成的空间构型为正四面体形,答案为:正四面体;③A.该晶胞结构与NaCl不相同,A错误;B.半导体EB与EF互为等电子体,B和F位于同一主族,价层电子数相同,所以它们属于等电子体,B正确;C.F和E同周期,但F的非金属性强于E,电负性:F>E,C正确;D.EF晶体属于原子晶体,原子间通过配位键相连,所以晶体中含有配位键,D正确,答案为:BCD;④(CH3)3E中E原子的价层电子对数为3+(3-3x1)=3,所以(CH3)3E中E原子杂化方式为sp2杂化,答案为:sp2;⑤设晶胞棱边的长度为a,晶体中紧邻的F原子之间的距离为面对角线的1/2,即为![]() ,紧邻的F、E两原子之间距离为晶胞体对角线的1/4,那么E、F间的距离为
,紧邻的F、E两原子之间距离为晶胞体对角线的1/4,那么E、F间的距离为![]() 的,晶体中紧邻的F原子之间的距离与紧邻的F、E两原子之间距离的比值为
的,晶体中紧邻的F原子之间的距离与紧邻的F、E两原子之间距离的比值为![]() ,答案为:
,答案为:![]()