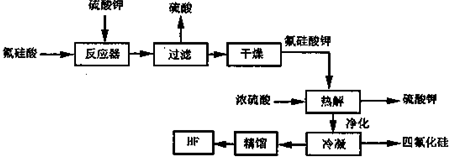
题目内容
12.通常情况下,氮气性质不活泼,其原因是( )| A. | 氮分子是双原子分子 | B. | 氮元素的非金属性很强 | ||
| C. | 氮原子的半径较小 | D. | 氮分子中的化学键很难破坏 |
分析 氮气分子为两个氮原子通过共用3对电子形成共价键,该N≡N非常稳定,破坏需要吸收很高的能量,据此解答.
解答 解:氮气分子中存在N≡N键,氮氮三键性质稳定,破坏时需要吸收很高的能量,所以氮气性质不活泼,
故选:D.
点评 本题考查了氮气的化学性质,熟悉氮气分子所含化学键特点是解题关键,注意对基础知识的积累.

练习册系列答案
相关题目
2.如图装置中能构成原电池产生电流的是( )
| A. | 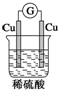 | B. | 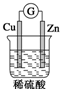 | C. | 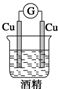 | D. | 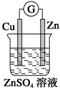 |
20.以下有关原子结构及元素周期律的叙述正确的是( )
| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 第VIIA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 元素的最高正价数均等于该元素原子的最外层电子数 |
7.检验二氧化硫中是否含有二氧化碳,应采用的方法是( )
| A. | 通过澄清石灰水 | |
| B. | 先通过碳酸氢钠溶液,再通过澄清石灰水 | |
| C. | 通过品红溶液 | |
| D. | 先通过足量的溴水,再通过澄清石灰水 |
17.下列说法正确的是( )
| A. | 反应条件是加热的反应都是吸热反应 | |
| B. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| C. | 物质相互混合就能发生的反应,是放热反应 | |
| D. | 放热的化学反应不需要加热就能发生 |
4.某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:用10ml H2O2制取150ml(标准状况下)O2所需的时间(s):
①该小组在设计方案时,考虑了浓度、温度、催化剂等因素对H2O2分解速率的影响.
②推测t的范围为480℃~720℃.
(2)将质量相同但聚集状态不同的MnO2分别加入15ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
①写出上述实验中发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②实验结果表明,催化剂的催化效果与催化剂的聚集状态(或表面积)有关.
③写出常见的另一种制取氧气的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:用10ml H2O2制取150ml(标准状况下)O2所需的时间(s):
| 浓度 反应条件 时间(s) | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360℃ | 480℃ | t℃ | 720℃ |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
②推测t的范围为480℃~720℃.
(2)将质量相同但聚集状态不同的MnO2分别加入15ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所 需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
②实验结果表明,催化剂的催化效果与催化剂的聚集状态(或表面积)有关.
③写出常见的另一种制取氧气的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
1.甲醇、氧气和强碱溶液作电解质的手机电池中的反应为2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O,有关说法正确的是( )
| A. | 充电时化学能转化为电能 | |
| B. | 放电时,负极电极反应式为:CH3OH+8OH--6e-=CO${\;}_{3}^{2-}$+6H2O | |
| C. | 标况下,通入的11.2L氧气完全反应有1mol电子转移 | |
| D. | 充电时电解质溶液的碱性逐渐减小 |