题目内容
4.某实验小组对H2O2的分解做了如下探究:(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:用10ml H2O2制取150ml(标准状况下)O2所需的时间(s):
| 浓度 反应条件 时间(s) | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360℃ | 480℃ | t℃ | 720℃ |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
②推测t的范围为480℃~720℃.
(2)将质量相同但聚集状态不同的MnO2分别加入15ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所 需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
②实验结果表明,催化剂的催化效果与催化剂的聚集状态(或表面积)有关.
③写出常见的另一种制取氧气的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
分析 (1)①由表格数据可知,浓度、温度不同,是否使用催化剂不同;
②由表格数据可知,温度升高;
(2)①过氧化氢在催化剂作用下分解生成水和氧气;
②接触面积大,反应速率快;
③还可利用过氧化钠与水反应制备氧气.
解答 解:(1)①由表格数据可知,浓度、温度不同,是否使用催化剂不同,则该实验在设计方案时,考虑了浓度、温度、催化剂等因素对H2O2分解速率的影响,
故答案为:温度;催化剂;
②由表格数据可知,温度升高,则t的范围为480℃~720℃,故答案为:480℃~720℃;
(2)①实验中发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②由实验可知,只有状态不同,粉末状反应剧烈,则催化剂的催化效果与催化剂的聚集状态(或表面积)有关,故答案为:催化剂的聚集状态(或表面积);
③常见的另一种制取氧气的化学方程式如2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查反应速率影响因素的实验探究,为高频考点,把握常见的影响因素及控制变量法探究实验为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
14.氡(${\;}_{86}^{222}$Rn)可从矿泉水、岩石、地下水、天然气、建筑材料中源源不断地释放出来.它可通过呼吸进入人体,停留在呼吸道中,放出α射线,其衰变产物还能放出β、γ射线.这些射线可诱发肺癌.关于氡的下列叙述不正确的是( )
| A. | Rn的原子核内中子数与质子数的差值为50 | |
| B. | Rn位于元素周期表中第六周期0族 | |
| C. | Rn的最外层电子排布式为6s26p6,化学性质不活泼 | |
| D. | 新铺大理石地面的居室,不用打开门窗换气,因为氡对人体无危害 |
15.设NA为阿伏加德罗常数.下列叙述不正确的是( )
| A. | 标准状况下,22.4 L O3含有分子的数目为NA | |
| B. | 常温常压下,4.0 g CH4中含有共价键的数目为NA | |
| C. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| D. | 标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1NA |
12.通常情况下,氮气性质不活泼,其原因是( )
| A. | 氮分子是双原子分子 | B. | 氮元素的非金属性很强 | ||
| C. | 氮原子的半径较小 | D. | 氮分子中的化学键很难破坏 |
19.下列说法正确的是( )
| A. | 钠原子失去一个电子后,它的电子数与氖原子相同,所以变成氖原子 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们是互为同位素 |
16.下列关于化学电源的有关说法中,正确的是( )
| A. | 锌锰干电池中石墨棒作负极 | |
| B. | 氢氧燃料电池工作时,氢气在负极发生还原反应 | |
| C. | 铅蓄电池放电时,两极质量均增加 | |
| D. | 燃料电池的能量转化率可达100% |
13.下列说法正确的是( )
| A. | 阴、阳离子间通过静电引力而形成的化学键称为离子键 | |
| B. | 在MgO和CO2 晶体中都不存在单个分子 | |
| C. | 金属中存在自由移动的带电微粒,所以能导电 | |
| D. | 离子晶体中存在带电微粒,所以能导电 |
5.下列关于ⅡA族元素的说法中,不正确的是( )
| A. | 元素的主要化合价都是+2价 | |
| B. | 元素的单质都呈银白色 | |
| C. | 有的元素的单质可在自然界中稳定存在 | |
| D. | 其中包括被誉为“国防金属”的元素 |
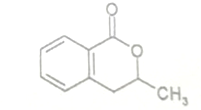
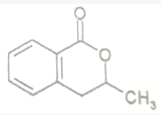 +H2O$\stackrel{NaOH}{→}$
+H2O$\stackrel{NaOH}{→}$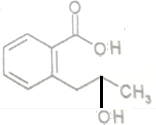 .
.