题目内容
20.以下有关原子结构及元素周期律的叙述正确的是( )| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 第VIIA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 元素的最高正价数均等于该元素原子的最外层电子数 |
分析 A.互为同位素原子的质子数相同;
B.同周期自左而右非金属性增强,得电子能力增强,最高价含氧酸的酸性增强;
C.非金属性越强,氢化物越稳定;
D.O元素、F元素没有最高正化合价.
解答 解:A.同位素137Cs比133Cs均属于Cs元素,质子数相同,故A错误;
B.同周期自左而右非金属性增强,得电子能力增强,最高价含氧酸的酸性增强,故P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强,故B正确;
C.同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,故第VIIA族元素从上到下,其氢化物的稳定性逐渐减弱,故C错误;
D.O元素、F元素没有最高正化合价,且过渡元素的最高正化合价一般高于最外层电子数,故D错误,
故选B.
点评 本题考查原子结构与元素周期律,难度不大,D选项中学生容易形成定式思维,只考虑主族元素(注意O元素、F元素没有最高正化合价),而忽略过渡元素、稀有气体,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列说法中不正确的是( )
| A. | 19世纪中叶,门捷列夫的突出贡献是发现元素周期律 | |
| B. | 在金属和非金属元素交界处最容易找到半导体材料 | |
| C. | 在过渡元素中容易找到各种优良的催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 根据硼在元素周期表中的位置,推测硼的最高价含氧酸的化学式可能是HBO3 |
8.反应2A(g)?2B(g)+C(g)△H>0,达平衡时,要使v(正)增大、c(A) 降低,应采取的措施是( )
| A. | 加压 | B. | 加催化剂 | C. | 降温 | D. | 升温 |
15.设NA为阿伏加德罗常数.下列叙述不正确的是( )
| A. | 标准状况下,22.4 L O3含有分子的数目为NA | |
| B. | 常温常压下,4.0 g CH4中含有共价键的数目为NA | |
| C. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| D. | 标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1NA |
12.通常情况下,氮气性质不活泼,其原因是( )
| A. | 氮分子是双原子分子 | B. | 氮元素的非金属性很强 | ||
| C. | 氮原子的半径较小 | D. | 氮分子中的化学键很难破坏 |
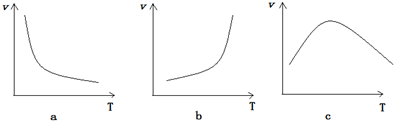
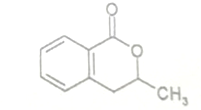
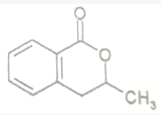 +H2O$\stackrel{NaOH}{→}$
+H2O$\stackrel{NaOH}{→}$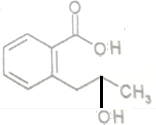 .
.