题目内容
17.下列说法正确的是( )| A. | 反应条件是加热的反应都是吸热反应 | |
| B. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| C. | 物质相互混合就能发生的反应,是放热反应 | |
| D. | 放热的化学反应不需要加热就能发生 |
分析 A.反应是吸热还是放热与反应条件无关;
B.化学反应中除了遵循质量守恒定律,还遵循能量守恒定律;
C.氯化铵与氢氧化钡晶体混合就能发生;
D.反应是吸热还是放热与是否加热无关.
解答 解:A.反应是吸热还是放热与反应条件无关,所有的燃烧均为放热反应,需要加热引燃,故A错误;
B.化学反应中除了遵循质量守恒定律,还遵循能量守恒定律,化学反应中的能量变化通常表现为热量的变化.所以化学反应除了生成新的物质外,还伴随着能量的变化,能量变化通常表现为热量的变化,即放热和吸热,故B正确;
C.氯化铵与氢氧化钡晶体混合就能发生,但是为吸热反应,故C错误;
D.放热反应有的需加热,有的不需加热.如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点,故D错误;故选B.
点评 关于解答化学中吸热或放热的类型题时,应该熟练记住吸热或放热的判断规律,可以起到事半功倍的目的.

练习册系列答案
相关题目
7.某学生为了探究锌与盐酸反应过程中的速率变化.在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如表:
(1)解释2min~3min反应速率最大的原因该反应是放热反应,2min~3min时溶液温度最高,反应速率最快;反应速率最小的时间段是4min~5min,原因为此时反应物的浓度最小,反应速率最慢.
(2)在4min~5min时间段内,用盐酸的浓度变化表示的反应速率为0.02mol•L-1•min-1.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液:
A.Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
你认为不可行的是A、C、D.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50.0 | 120.0 | 232.0 | 290.0 | 312.4 |
(2)在4min~5min时间段内,用盐酸的浓度变化表示的反应速率为0.02mol•L-1•min-1.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液:
A.Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
你认为不可行的是A、C、D.
8.反应2A(g)?2B(g)+C(g)△H>0,达平衡时,要使v(正)增大、c(A) 降低,应采取的措施是( )
| A. | 加压 | B. | 加催化剂 | C. | 降温 | D. | 升温 |
12.通常情况下,氮气性质不活泼,其原因是( )
| A. | 氮分子是双原子分子 | B. | 氮元素的非金属性很强 | ||
| C. | 氮原子的半径较小 | D. | 氮分子中的化学键很难破坏 |
2.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)≒Y(g)+Z (s),以下能说明作为反应达到平衡标志的是( )
| A. | X的分解速率与Y的消耗速率相等 | |
| B. | X、Y与Z的物质的量之比为2:1:1 | |
| C. | 混合气体的密度不再变化 | |
| D. | 单位时间内生成lmolY的同时分解1mol X |
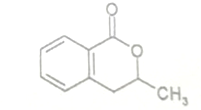
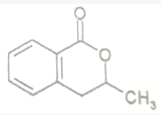 +H2O$\stackrel{NaOH}{→}$
+H2O$\stackrel{NaOH}{→}$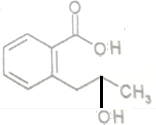 .
.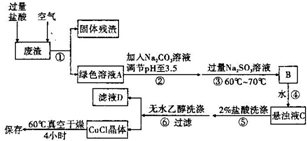 通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.
通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.