题目内容
3.5.8g有机物完全燃烧,只生成CO2和H2O气且体积比为1:1(同温同压),若把它们通过碱石灰,碱石灰质量增加18.6g,等量的该有机物与0.1mol乙酸完全发生酯化反应.又知该有机物对空气的相对密度为2.求:(1)有机物的相对分子质量;
(2)有机物的分子式.
分析 (1)该有机物对空气的相对密度为2,则有机物相对分子质量=29×2=58;
(2)5.8g有机物的物质的量为0.1mol,燃烧生成CO2和H2O气且体积比为1:1,碱石灰在增加18.6g为CO2和H2O的质量,计算二者物质的量,根据原子守恒计算分子中C、H原子数目,再根据相对分子质量计算O原子数目,进而确定有机物分子式.
解答 解:(1)空气的平均分子量为29,相对密度与相对分子质量成正比,该有机物对空气的相对密度为2,则有机物相对分子质量为:29×2=58,
答:该有机物的相对分子质量为58;
(2)5.8g有机物的物质的量为:$\frac{5.8g}{58g/mol}$=0.1mol,完全燃烧生成CO2和H2O气且体积比为1:1,碱石灰在增加18.6g为CO2和H2O的质量,则18n(H2O)+44n(CO2)=18.6,解得:n(CO2)=n(H2O)=$\frac{18.6}{44n+18n}$mol=0.3mol,
则有机物分子中N(C)=$\frac{0.3mol}{0.1mol}$═3、N(H)=$\frac{0.3mol×2}{0.1mol}$=6、N(O)=$\frac{58-12×3-6}{16}$=1,
故有机物分子式为:C3H6O,
答:该有机物分子式为C3H6O.
点评 本题考查了有机物分子式的确定,题目难度中等,明确相对密度与相对分子质量的关系为解答关键,注意掌握质量守恒在确定有机物分子式中的应用方法.

练习册系列答案
相关题目
13.下列变化属于化学变化的是( )
| A. | 氨的液化 | B. | 氯化铵受热“升华” | ||
| C. | 碘的升华 | D. | 硝酸的挥发 |
14.氡(${\;}_{86}^{222}$Rn)可从矿泉水、岩石、地下水、天然气、建筑材料中源源不断地释放出来.它可通过呼吸进入人体,停留在呼吸道中,放出α射线,其衰变产物还能放出β、γ射线.这些射线可诱发肺癌.关于氡的下列叙述不正确的是( )
| A. | Rn的原子核内中子数与质子数的差值为50 | |
| B. | Rn位于元素周期表中第六周期0族 | |
| C. | Rn的最外层电子排布式为6s26p6,化学性质不活泼 | |
| D. | 新铺大理石地面的居室,不用打开门窗换气,因为氡对人体无危害 |
18.已知有机物甲、乙、丙有如下信息:
据此推断:
(1)甲的分子式为C3H8,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有4种.
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂.其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为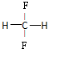 .
.
(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为C2H5F.
| 甲 | 乙 | 丙 | |
| 所含元素 | C、H | C、H、F | C、H、F |
| 所含电子数 | 26 | ||
| 结构特点 | 饱和有机物 | ||
(1)甲的分子式为C3H8,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有4种.
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂.其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为
 .
.(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为C2H5F.
8.反应2A(g)?2B(g)+C(g)△H>0,达平衡时,要使v(正)增大、c(A) 降低,应采取的措施是( )
| A. | 加压 | B. | 加催化剂 | C. | 降温 | D. | 升温 |
15.设NA为阿伏加德罗常数.下列叙述不正确的是( )
| A. | 标准状况下,22.4 L O3含有分子的数目为NA | |
| B. | 常温常压下,4.0 g CH4中含有共价键的数目为NA | |
| C. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| D. | 标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1NA |
12.通常情况下,氮气性质不活泼,其原因是( )
| A. | 氮分子是双原子分子 | B. | 氮元素的非金属性很强 | ||
| C. | 氮原子的半径较小 | D. | 氮分子中的化学键很难破坏 |
13.下列说法正确的是( )
| A. | 阴、阳离子间通过静电引力而形成的化学键称为离子键 | |
| B. | 在MgO和CO2 晶体中都不存在单个分子 | |
| C. | 金属中存在自由移动的带电微粒,所以能导电 | |
| D. | 离子晶体中存在带电微粒,所以能导电 |