题目内容
1.甲醇、氧气和强碱溶液作电解质的手机电池中的反应为2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O,有关说法正确的是( )| A. | 充电时化学能转化为电能 | |
| B. | 放电时,负极电极反应式为:CH3OH+8OH--6e-=CO${\;}_{3}^{2-}$+6H2O | |
| C. | 标况下,通入的11.2L氧气完全反应有1mol电子转移 | |
| D. | 充电时电解质溶液的碱性逐渐减小 |
分析 根据2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O可知,甲醇失去电子发生氧化反应,所以负极上燃料发生电极反应;氧气得电子发生还原反应,所以正极为氧气得电子发生还原反应,1mol氧气反应转移4mol电子,根据电极反应式判断电极附近溶液的pH值变化.
解答 解:A、正极上得电子发生还原反应,根据2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O知,充电时,电能转化为化学能,故A错误;
B、放电时,负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故B正确;
C、2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O 转移电子
67.2L 12mol
11.2L 2mol
所以,标况下,通入11.2LO2并完全反应后,有2mol电子转移,故C错误;
D、放电时,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为$\frac{3}{2}$O2+3H2O+6e-=6OH-,所以通入氧气的电极附近溶液的pH升高,故D错误;
故选B.
点评 本题以燃料电池为载体考查了原电池原理,根据电池反应式判断正负极上发生反应的物质及电极附近溶液PH值的变化即可解答本题,难度较大.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
12.通常情况下,氮气性质不活泼,其原因是( )
| A. | 氮分子是双原子分子 | B. | 氮元素的非金属性很强 | ||
| C. | 氮原子的半径较小 | D. | 氮分子中的化学键很难破坏 |
16.下列关于化学电源的有关说法中,正确的是( )
| A. | 锌锰干电池中石墨棒作负极 | |
| B. | 氢氧燃料电池工作时,氢气在负极发生还原反应 | |
| C. | 铅蓄电池放电时,两极质量均增加 | |
| D. | 燃料电池的能量转化率可达100% |
13.下列说法正确的是( )
| A. | 阴、阳离子间通过静电引力而形成的化学键称为离子键 | |
| B. | 在MgO和CO2 晶体中都不存在单个分子 | |
| C. | 金属中存在自由移动的带电微粒,所以能导电 | |
| D. | 离子晶体中存在带电微粒,所以能导电 |
2.下列关于物质分类的说法正确的是( )
| A. | 根据是否具有丁达尔现象把分散系分为溶液、胶体、浊液 | |
| B. | 根据在水溶液里或熔化状态下是否导电把物质分为电解质、非电解质 | |
| C. | 凡是含有碳元素的物质为有机物,不含碳元素的物质为无机物 | |
| D. | 根据密度大小把金属分为轻金属和重金属 |
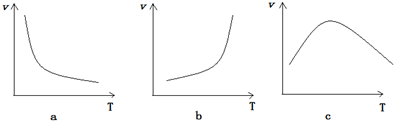
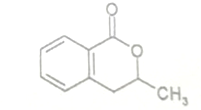
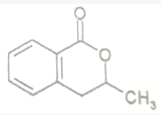 +H2O$\stackrel{NaOH}{→}$
+H2O$\stackrel{NaOH}{→}$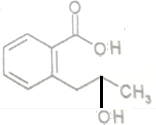 .
.