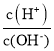��Ŀ����
����Ŀ��������Ԫ�����ڱ���һ���֣����բ١���Ԫ���ڱ��е�λ�ã����û�ѧ����ش��������⣺
����/���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� |
��1���ܡ��ݡ�������Ԫ���У����Ӱ뾶��С��˳��Ϊ__________�������ӷ��ţ���
��2���ڡ��ߡ������ۺ������������ǿ������˳����_________���ѧʽ����
��3��������ݵ�����������ˮ���ﷴӦ�����ӷ���ʽΪ��_____________��
��4����˵����ķǽ����ԱȢ�ķǽ�����_________������ǿ����������������ʵ��____________________________�������ӷ���ʽ˵������
��5���ٺ͢��γɵ�18���ӵĻ��������һ��Ӧ�ù㷺�Ļ���ԭ�ϣ�д���ĵ���ʽ��_________��ʵ�����п��ô���������Һ�백��Ӧ�Ʊ��ף���Ӧ�Ļ�ѧ����ʽΪ��____________________________��
���𰸡�S2-��O2-��Na+ H2SO4��H2CO3��H2SiO3 2Al + 2OH- + 2H2O = 2Al02- + 3H2�� �� Cl2 + S2- = 2Cl- + S���������������𰸣� 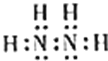 2NH3 + NaClO = N2H4 + NaCl + H2O
2NH3 + NaClO = N2H4 + NaCl + H2O
��������
����Ԫ�������ڱ��е�λ�ÿ�֪����ΪH����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪSi����ΪS����ΪCl���ݴ˷�����
����Ԫ�������ڱ��е�λ�ÿ�֪����ΪH����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪSi����ΪS����ΪCl��
��1���ܡ��ݡ�������Ԫ���У�S2-��һ�����Ӳ㣬���Ӱ뾶���O2-��Na+������ͬ���Ӳ�ṹ���˵������İ뾶С�������Ӱ뾶��С��˳��ΪS2-��O2-��Na+��
��2��Ԫ�طǽ�����Խǿ������ۺ����������Խǿ���ڡ��ߡ���ķǽ�����S��C��Si������ۺ������������ǿ������˳����H2SO4��H2CO3��H2SiO3��
��3������Al��ݵ�����������ˮ����NaOH��Ӧ�����ӷ���ʽΪ��2Al + 2OH- + 2H2O = 2AlO2- + 3H2����
��4����ԭ�ԣ�Cl-��S2-����ǽ�����Cl��S����˵����Ԫ�صķǽ����Ա���Ԫ��ǿ������˵����ķǽ����ԱȢ�ķǽ�����������ʵ��Cl2 + S2- = 2Cl- + S����
��5���ٺ͢��γɵ�18���ӵĻ�����ķ���ʽΪN2H4���ĵ���ʽΪ![]() ��ʵ�����п��ô���������Һ�백��Ӧ�Ʊ��ף�ͬʱ�����Ȼ��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��2NH3 + NaClO = N2H4 + NaCl + H2O��
��ʵ�����п��ô���������Һ�백��Ӧ�Ʊ��ף�ͬʱ�����Ȼ��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��2NH3 + NaClO = N2H4 + NaCl + H2O��

 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д�