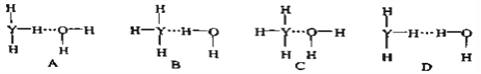题目内容
【题目】一定条件下,在密闭容器发生可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O (g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
4NO(g) +6H2O (g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
A. 正逆反应速率相等且等于零
B. NH3、O2、NO和H2O浓度均相等
C. NH3、O2、NO和H2O在容器中共存
D. NH3、O2、NO和H2O浓度不再发生变化
【答案】D
【解析】A、平衡时正逆反应速率相等但不等于零,A错误;B、NH3、O2、NO和H2O浓度均相等不能说明正逆反应速率相等,反应不一定处于平衡状态,B错误;C、NH3、O2、NO和H2O在容器中共存不能说明正逆反应速率相等,反应不一定处于平衡状态,C错误;D、NH3、O2、NO和H2O浓度不再发生变化能说明正逆反应速率相等,反应一定处于平衡状态,D正确,答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为探究H2O2制备氧气,生成氧气速率的影响因素,某同学设计了如下一系列实验。
实验编号 | 反应物 | 催化剂 |
甲 | 试管中加入3 mL 2% H2O2溶液和3滴蒸馏水 | 无 |
乙 | 试管中加入3 mL 5% H2O2溶液和3滴蒸馏水 | 无 |
丙 | 试管中加入3 mL 5% H2O2溶液和3滴蒸馏水 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
丁 | 试管中加入3 mL 5% H2O2溶液和3滴稀盐酸溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
戊 | 试管中加入3 mL 5% H2O2溶液和3滴NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
[查阅资料] 过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气。研究表明,将新制的5%的H2O2溶液加热到65 ℃时就有氧气放出,加热到80 ℃时就有较多氧气产生。
(1)实验丙、实验丁和实验戊的实验目的是_____________________________________。
(2)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?______
(3)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
①对实验丁,20~40 s的反应速率v1=_____mL·s-1,100~120 s的反应速率v2=_____mL·s-1。不考虑实验测量误差,二者速率存在差异的主要原因是_____________________________________。
②如图是根据实验收集到最大体积的气体时所用时间绘制的图像。曲线c表示的是实验 ______(填“丙”“丁”或“戊”)。