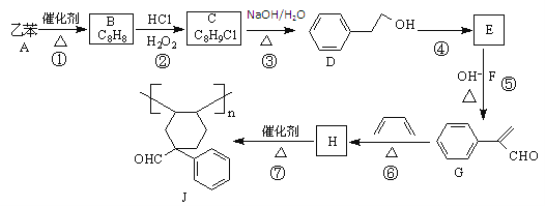
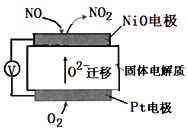
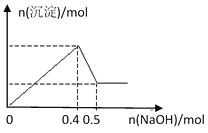
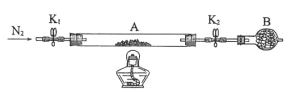
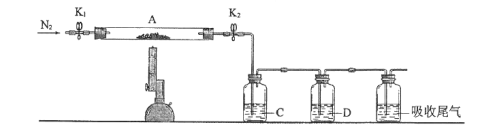
��Ŀ����
����Ŀ����1����1L1mol/L��NaOH��Һ�м����������ʣ���ŨH2SO4����ϡ�����ϡ���ᣬǡ����ȫ��Ӧ����ЧӦΪ��H1����H2����H3 �� ��������С����˳��Ϊ________
��2���ɸ�˹���ɽ��������Ӧ����ʽ���ش����⣺
��NH3��g��+HCl��g���TNH4Cl��s����H=��176kJ/mol
��NH3��g��+H2O��l���TNH3H2O��aq����H=��35.1kJ/mol
��HCl��g��+H2O��l���THCl��aq����H=��72.3kJ/mol
��NH3H2O��aq��+HCl��aq���TNH4Cl��aq����H=��52.3kJ/mol
��NH4Cl��s��+2H2O��l���TNH4Cl��aq������H����_________ kJ/mol��
��3�����������Ȼ�ѧ����ʽ������д��C��s��ȼ���ȵ��Ȼ�ѧ����ʽ________
C��s��+H2O��l���TCO��g��+H2��g����H1=+175.3kJmol��1
2CO��g��+O2��g���T2CO2��g����H2=��566.0kJmol��1
2H2��g��+O2��g���T2H2O��l����H3=��571.6kJmol��1 ��
���𰸡���H1����H2����H3 +16.3 C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
��������
��1��ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦ��H����aq��ʮOH����aq��=H2O��H=һ57.3kJ��mol��1���ֱ���1L1mol��L��1��NaOH��Һ�м��룺��ŨH2SO4����ϡ�����ϡ���ᣬ����ĵ������ȣ�Ũ��������ˮ���ȣ�ǡ����ȫ��Ӧʱ�ķų�������Ϊ�٣��ڣ��ۣ�������H1����H2����H3���ʴ�Ϊ����H1����H2����H3��
��2�����ݸ�˹���ɣ���+��-��+�۵�
NH4Cl��s��+H2O��l��=NH4Cl��aq����H=��-35.1kJ��mol��1��+��-52.3kJ��mol��1��-��-176kJ��mol��1��+��-72.3kJ��mol��1��
��NH4Cl��s��+H2O��l��=NH4Cl��aq����H=+16.3kJ��mol��1��
�ʴ�Ϊ��+16.3��
��3����C��s��+H2O��l��=CO��g��+H2��g����H1=+175.3kJ��mol��1
��2CO��g��+O2��g��=2CO2��g����H2=-566.0kJ��mol��1
��2H2��g��+O2��g��=2H2O��l����H3=-571.6kJ��mol��1��
���ݸ�˹���ɣ���+����![]() +����
+����![]() �ã�C��s��+O2��g��=CO2��g����H=-393.5 kJ��mol��1��
�ã�C��s��+O2��g��=CO2��g����H=-393.5 kJ��mol��1��
�ʴ�Ϊ��C��s��+O2��g��=CO2��g����H=-393.5 kJ��mol��1��

����Ŀ���й���ͳ�Ļ��������������Ŵ������м����˹Ŵ���ѧ�о��ɹ������г�����ʫ�Ķ�Ӧ�Ļ�ѧ֪ʶ��ȷ����
������ʫ�ļ��� | ��ѧ֪ʶ | |
A | ����Ϫ��̸���жԱ����ļ��أ��������Լ���Ϊ�У�����Ϊ���ɣ����������ۡ� | ���ĺϽ�Ӳ�ȱȴ����Ĵ��۵�ȴ����ĸ� |
B | �����ݸ�Ŀʰ�š��ж�ǿˮ�ļ��أ��������ң���ʴ�����ˮ��ǿ��Ω������ʢ�� | ǿˮΪ����� |
C | ���칤����м��أ�����ҩ����Ϊ��������Ϊ���� | ��ָ������ƣ���ָ��������� |
D | ��Ȫ�ݸ�־���м��أ������˻�����Ϊլ���ǣ�ǽ��ѹ�ǣ�ȥ�����ǰף�������Ч֮ | �ǰĹ��̷����˻�ѧ�仯 |
A. AB. BC. CD. D
����Ŀ��������Ԫ�����ڱ���һ���֣����բ١���Ԫ���ڱ��е�λ�ã����û�ѧ����ش��������⣺
����/���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� |
��1���ܡ��ݡ�������Ԫ���У����Ӱ뾶��С��˳��Ϊ__________�������ӷ��ţ���
��2���ڡ��ߡ������ۺ������������ǿ������˳����_________���ѧʽ����
��3��������ݵ�����������ˮ���ﷴӦ�����ӷ���ʽΪ��_____________��
��4����˵����ķǽ����ԱȢ�ķǽ�����_________������ǿ����������������ʵ��____________________________�������ӷ���ʽ˵������
��5���ٺ͢��γɵ�18���ӵĻ��������һ��Ӧ�ù㷺�Ļ���ԭ�ϣ�д���ĵ���ʽ��_________��ʵ�����п��ô���������Һ�백��Ӧ�Ʊ��ף���Ӧ�Ļ�ѧ����ʽΪ��____________________________��