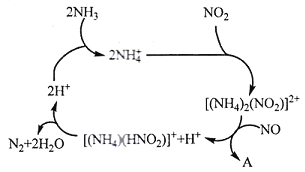
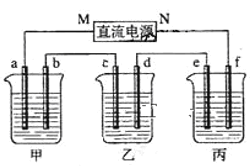
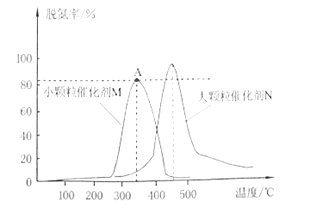
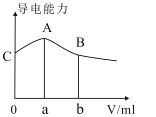
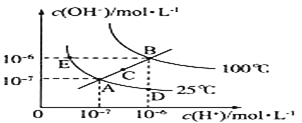
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molNa2O2中阴离子的数目为0.2NA
B.1L0.1mol/L的HF溶液中F-数目为0.1NA
C.0.1molFe在点燃条件下与氧气反应时转移电子数目为0.3NA
D.0.4mol浓盐酸与足量的MnO2加热充分反应,产生Cl2的数目小于0.1NA
【答案】D
【解析】
A.1molNa2O2中阴离子过氧根的物质的量为1mol, 0.1molNa2O2中阴离子的物质的量为0.1mol,数目为0.1NA,故A错误;
B.1L0.1mol/L的HF溶液的物质的量n=cV=0.1mol/L× 1L=0.1mol,如果HF完全电离的话,F-的物质的量为0.1mol,数目为N=nNA=0.1 NA,HF是弱酸,不能完全电离,故F-数目小于0.1NA,故B错误;
C.铁在氧气中燃烧生成四氧化三铁,3Fe+2O2=Fe3O4,3mol铁转移8mol电子,1mol铁转移![]() mol电子,则0.1moFe在氧气中燃烧转移的电子数小于0.3NA,故C错误;
mol电子,则0.1moFe在氧气中燃烧转移的电子数小于0.3NA,故C错误;
D.二氧化锰与浓盐酸反应,不与稀盐酸反应,依据方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,所以0.4mol浓盐酸如果完全反应生成0.1molCl2,但是由于反应过程中,浓盐酸浓度不断降低,HCl不能完全消耗,所以得到的Cl2也就小于0.1mol,HCl分子数小于0.1NA,故D正确。
MnCl2+Cl2↑+2H2O,所以0.4mol浓盐酸如果完全反应生成0.1molCl2,但是由于反应过程中,浓盐酸浓度不断降低,HCl不能完全消耗,所以得到的Cl2也就小于0.1mol,HCl分子数小于0.1NA,故D正确。
答案选D。

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案【题目】下面是元素周期表的一部分,参照①~⑧元素在表中的位置,请用化学用语回答下列问题:
周期/主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)④、⑤、⑧三种元素中,离子半径大小的顺序为__________(填离子符号)。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_________(填化学式)。
(3)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为:_____________。
(4)能说明⑧的非金属性比⑨的非金属性_________(填“强”或“弱”)的事实是____________________________(用离子方程式说明)。
(5)①和③形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的电子式:_________,实验室中可用次氯酸钠溶液与氨反应制备甲,反应的化学方程式为:____________________________。