题目内容
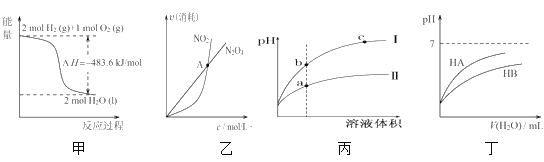
【题目】常温下,用0.1molL-1的氨水滴定10.00 mL0.1molL-1的酸HA溶液,所加氨水的体积(V)与溶液中lg 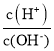 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
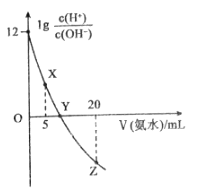
A.溶液中水的电离程度X<Y<Z
B.X点:c(A-)>c(H+)>c(NH4+)>c(OH-)
C.Y点:V(氨水)<10.00mL
D.Z点:2c(H+)+c(NH4+)=2c(OH-)+c(NH3H2O)
【答案】AC
【解析】
根据起点,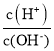 =1012,则溶液中c(H+)=0.1mol·L-1,说明HA为强酸,然后根据计量点,推出该点的物质,利用电荷守恒、物料守恒等进行分析;
=1012,则溶液中c(H+)=0.1mol·L-1,说明HA为强酸,然后根据计量点,推出该点的物质,利用电荷守恒、物料守恒等进行分析;
根据起点,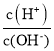 =1012,则溶液中c(H+)=0.1mol·L-1,说明HA为强酸,
=1012,则溶液中c(H+)=0.1mol·L-1,说明HA为强酸,
A. 根据图像,纵坐标从0~12,溶液中c(H+)增大,0以下,溶液中c(OH-)增大,即三点中,Y点水的电离程度最大,故A说法错误;
B. X点加入5mL氨水,反应溶质为NH4A和HA,且物质的量相等, HA为强酸完全电离HA=H++A-,NH4+水解:NH4++H2O![]() NH3·H2O+H+,水中H2O
NH3·H2O+H+,水中H2O ![]() H++OH-,从而推出溶液显酸性,离子浓度大小顺序是c(A-)>c(H+)>c(NH4+)>c(OH-),故B说法错误;
H++OH-,从而推出溶液显酸性,离子浓度大小顺序是c(A-)>c(H+)>c(NH4+)>c(OH-),故B说法错误;
C. Y点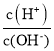 =1,溶液显中性,恰好完全时,消耗10mL氨水,此时溶质为NH4A,溶液显酸性,因此为使溶液显中性,需要多加一部分氨水,即Y点V(NH3·H2O)>10.00mL,故C说法错误;
=1,溶液显中性,恰好完全时,消耗10mL氨水,此时溶质为NH4A,溶液显酸性,因此为使溶液显中性,需要多加一部分氨水,即Y点V(NH3·H2O)>10.00mL,故C说法错误;
D. Z点加入氨水20.00mL,反应后溶液中的溶质为NH4A和NH3·H2O,且物质的量相等,根据电荷守恒,c(H+)+c(NH4+)=c(OH-)+c(A-),根据物料守恒,c(NH4+)+c(NH3·H2O=2c(A-),两式联立解得:2c(H+)+c(NH4+)=2c(OH-)+c(NH3·H2O),故D说法正确;
答案:AC。

 寒假天地重庆出版社系列答案
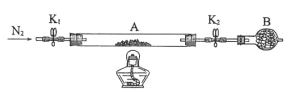
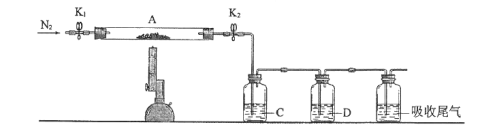
寒假天地重庆出版社系列答案【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化变成绿色;见光分解变成褐色。如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl)生产CuCl的流程:
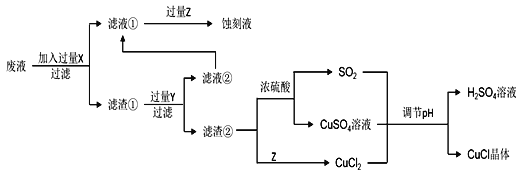
根据以上信息回答下列问题:
(1)生产过程中X的化学式为____。
(2)写出产生CuCl的离子方程式:____。
(3)实验探究pH对CuCl产率的影响如表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为____,当pH较大时CuCl产率变低原因是____。调节pH时,___(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是____。
(4)氯化亚铜的定量
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解。
②用0.10mol·L1硫酸铈标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。三次平行实验结果如表(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_____。(结果保留三位有效数字)。
(5)由CuCl水解再热分解可得到纳米Cu2O。第一步CuCl水解的离子方程式为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。
CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。
【题目】下面是元素周期表的一部分,参照①~⑧元素在表中的位置,请用化学用语回答下列问题:
周期/主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)④、⑤、⑧三种元素中,离子半径大小的顺序为__________(填离子符号)。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_________(填化学式)。
(3)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为:_____________。
(4)能说明⑧的非金属性比⑨的非金属性_________(填“强”或“弱”)的事实是____________________________(用离子方程式说明)。
(5)①和③形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的电子式:_________,实验室中可用次氯酸钠溶液与氨反应制备甲,反应的化学方程式为:____________________________。
【题目】工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%)。
| 0.1个大气压 | 0.5个大气压 | 1个大气压 | 10个大气压 |
400 | 99.2 | 99.6 | 99.7 | 99.9 |
500 | 93.5 | 96.9 | 97.8 | 99.3 |
600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)SO2的氧化反应是___反应(填“吸热”或“放热”)。
(2)根据图中所给信息,你认为工业上将SO2转化为SO3的适宜条件是___。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?___(填“是”或“否”)。
(4)若保持温度和容积不变,平衡后通入氧气,再达平衡时则SO2浓度___。(填“增大”或“减小”)
(5)若保持温度和压强不变,平衡后通入He气,SO3的含量___。(填“增大”或“减小”)