题目内容
已知H2O(g)= H2O(l) △H1=Q1 kJ/mol
C2H5OH(g) = C2H5OH(l), △H2=Q2 kJ/mol
C2H5OH(g)+3O2(g) =2CO2(g) + 3H2O(g), △H3=Q3 kJ/mol
若使用23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )kJ
C2H5OH(g) = C2H5OH(l), △H2=Q2 kJ/mol
C2H5OH(g)+3O2(g) =2CO2(g) + 3H2O(g), △H3=Q3 kJ/mol
若使用23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )kJ
| A.Q1 +Q2 +Q3 | B.0.5(Q1 +Q2 +Q3) |
| C.0.5Q1 –0.5Q2 +0.5Q3 | D.1.5Q1 –0.5Q2 +0.5Q 3 |
D
试题分析:①H2O(g)═H2O(l)△H1=-Q1kJ?mol-1(Q1>0),②C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ?mol-1(Q2>0),③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1(Q3>0),
根据盖斯定律可知,①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(-3Q1+Q2-Q3)kJ/mol,即1mol液态乙醇完全燃烧并恢复至室温,则放出的热量为(3Q1-Q2+Q3)kJ,则23g液态乙醇完全燃烧并恢复至室温,则放出的热量为0.5×(3Q1-Q2+Q3)kJ=(1.5Q1-0.5Q2+0.5Q3)kJ,故选D。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
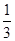 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
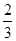 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在

 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原): 

 ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。 CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1 CH3OH(g)
CH3OH(g) 

 N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。 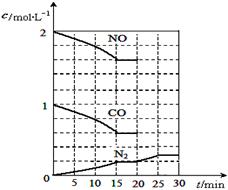
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。