题目内容
(Ⅰ)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)25℃、101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为: 。
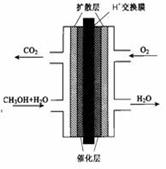
(2)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),写出该极的电极反应式 。
(Ⅱ)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是 电解液中H2SO4的浓度将变 ;
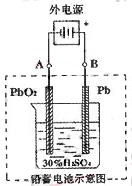
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成 B电极上生成 。
(1)25℃、101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为: 。
(2)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),写出该极的电极反应式 。

(Ⅱ)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-
 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原): (1)放电时:正极的电极反应式是 电解液中H2SO4的浓度将变 ;
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成 B电极上生成 。

(Ⅰ)(1)CH3OH(l) + 3/2 O2(g)= CO2(g) + 2H2O(l) △H ="-726.51" kJ/mol
(2)负 CH3OH + H2O -6 e-= CO2+ 6 H+
(Ⅱ)(1)PbO2+2e-+4H++SO42-=PbSO4+2H2O 小 (2)Pb PbO2
(2)负 CH3OH + H2O -6 e-= CO2+ 6 H+
(Ⅱ)(1)PbO2+2e-+4H++SO42-=PbSO4+2H2O 小 (2)Pb PbO2
试题分析:(Ⅰ)(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,以此书写热化学方程式;(2)甲醇燃料电池中,甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳;(Ⅱ)(1)电池总反应式为:Pb+PbO2+4H++2SO2-4
 2PbSO4+2H2O,写出电极反应为:负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++SO42-=PbSO4+2H2O,放电时:正极的电极反应式是PbO2+2e-+4H++2SO42-=PbSO4+2H2O;电解液中H2SO4的浓度将减少;当外电路通过1mol电子时,依据电子守恒计算理论上负极板的质量增加;(2)在完全放电耗尽PbO2和Pb时,电极上是析出的PbSO4,若按题右图连接B为阳极应是失去电子发生氧化反应,A为阴极是得到电子发生还原反应,实质是电解反应,B电极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++2SO42-,A电极发生反应为:PbSO4=Pb-2e-+SO42-,所以A电极上生成Pb;B极生成PbO2,此时铅蓄电池的正负极的极性将对换。
2PbSO4+2H2O,写出电极反应为:负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++SO42-=PbSO4+2H2O,放电时:正极的电极反应式是PbO2+2e-+4H++2SO42-=PbSO4+2H2O;电解液中H2SO4的浓度将减少;当外电路通过1mol电子时,依据电子守恒计算理论上负极板的质量增加;(2)在完全放电耗尽PbO2和Pb时,电极上是析出的PbSO4,若按题右图连接B为阳极应是失去电子发生氧化反应,A为阴极是得到电子发生还原反应,实质是电解反应,B电极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++2SO42-,A电极发生反应为:PbSO4=Pb-2e-+SO42-,所以A电极上生成Pb;B极生成PbO2,此时铅蓄电池的正负极的极性将对换。
练习册系列答案
相关题目
 Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。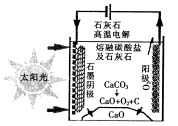
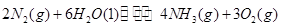
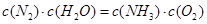
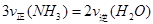
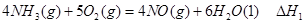 ①
①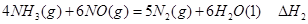 ②
②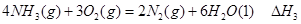 ③
③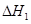 、
、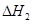 、
、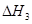 三者之间关系的表达式,
三者之间关系的表达式,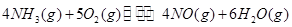
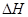 =
=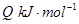


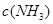
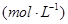
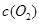
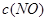
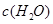
 [Cu(NH3)3]Ac?CO(aq)(△H<0)
[Cu(NH3)3]Ac?CO(aq)(△H<0)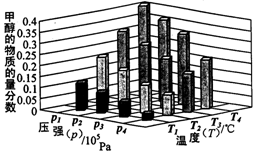
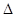 H= -221.0kJ/mmol
H= -221.0kJ/mmol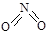 和
和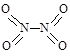 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 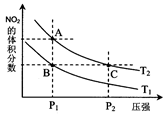
 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。 O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1