题目内容
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
则甲烷直接将NO2还原为N2的热化学方程为 。
(2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= 。
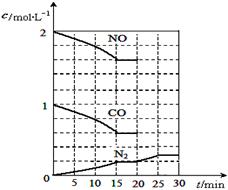
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)肼(N2H4)用亚硝酸(HNO2)氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式 。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
则甲烷直接将NO2还原为N2的热化学方程为 。
(2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应:
2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。 若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= 。

若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)肼(N2H4)用亚硝酸(HNO2)氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式 。
(1)CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1(2分)
(2)k=" 5/144" 或0.0347 (2分); 不(1分); ② (1分)
(3) N2H4 +HNO2==HN3 + 2H2O(2分)
(2)k=" 5/144" 或0.0347 (2分); 不(1分); ② (1分)
(3) N2H4 +HNO2==HN3 + 2H2O(2分)
试题分析:(1)根据盖斯定律,甲烷直接将NO2还原为N2的?H=1/2?H1+1/2?H2=-867kJ·mol-1,所以热化学方程式为:CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
(2)根据图中所示浓度可知c(CO2)=0.4mol/L,则
K=
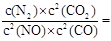
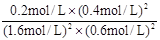 =
=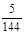
再向容器中充入CO、N2各0.6mol, Q仍为 5/144,所以平衡不移动;20min时,从图中看出平衡正向移动,N2起始浓度没变,所以选②。
(3) 根据氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,可求得分子式为HN3,该反应的化学方程式为:N2H4 +HNO2==HN3 + 2H2O

练习册系列答案
相关题目
 C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 
 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。

 mol;
mol;

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)

 O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1