题目内容
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

I.已知该产业链中某反应的平衡表常数达式为:K= ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为 。
830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
①此时刻v正 v逆(填“大于”“小于”或“等于”
②平衡时二甲醚的物质的量浓度是 。
以二甲醚、空气、KOH 溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ;若以1.12L/min(标准状况)的速率向电池中通入二甲醚,用该电池电解500mL2mol/L CuSO4溶液,通电0.50 min后,计算理论上可析出金属铜的质量为

I.已知该产业链中某反应的平衡表常数达式为:K=
 ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)
 CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1③CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1(1)催化反应室中总反应的热化学方程式为 。
830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol/L) | 0.8 | 1.24 | 1.24 |
①此时刻v正 v逆(填“大于”“小于”或“等于”
②平衡时二甲醚的物质的量浓度是 。
以二甲醚、空气、KOH 溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ;若以1.12L/min(标准状况)的速率向电池中通入二甲醚,用该电池电解500mL2mol/L CuSO4溶液,通电0.50 min后,计算理论上可析出金属铜的质量为
I.C(s) + H2O(g)  CO(g)+H2(g) (1分)
CO(g)+H2(g) (1分)
II.(1)3CO(g)+3H2(g) CH3OCH3(g) +CO2(g) △H1=-246.1kJ·mol-1 > (1分)
CH3OCH3(g) +CO2(g) △H1=-246.1kJ·mol-1 > (1分)
(2)0.1mol/(L·min) (1分) 5.4 (1分)
(3)大于(1分) 1.6mol/L (1分)
(4)CH3OCH3 -12e-+16OH - = 2CO32-+11H2O (1分) 9.6g (2分)
 CO(g)+H2(g) (1分)
CO(g)+H2(g) (1分)II.(1)3CO(g)+3H2(g)
 CH3OCH3(g) +CO2(g) △H1=-246.1kJ·mol-1 > (1分)
CH3OCH3(g) +CO2(g) △H1=-246.1kJ·mol-1 > (1分)(2)0.1mol/(L·min) (1分) 5.4 (1分)
(3)大于(1分) 1.6mol/L (1分)
(4)CH3OCH3 -12e-+16OH - = 2CO32-+11H2O (1分) 9.6g (2分)
试题分析:I.根据题给平衡常数表达式,结合质量守恒定律写出,化学方程式为
C(s) + H2O(g)
 CO(g)+H2(g);II.(1)根据盖斯定律,①×2+②+③得催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)
CO(g)+H2(g);II.(1)根据盖斯定律,①×2+②+③得催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)  CH3OCH3(g) +CO2(g) △H1=-246.1kJ·mol-1;该反应放热,降温平衡向正向移动,K增大,故在催化反应室中反应③的K>1.0;(2)根据v=△c/△t,将题给数据代入计算,v(CO)= 0.1mol/(L·min);根据平衡计算——三行式计算。
CH3OCH3(g) +CO2(g) △H1=-246.1kJ·mol-1;该反应放热,降温平衡向正向移动,K增大,故在催化反应室中反应③的K>1.0;(2)根据v=△c/△t,将题给数据代入计算,v(CO)= 0.1mol/(L·min);根据平衡计算——三行式计算。CO(g)+2H2(g)
 CH3OH(g) CO(g)+2H2(g)
CH3OH(g) CO(g)+2H2(g) CH3OH(g)
CH3OH(g)起始浓度(mol/L) 1 2.4 0 4 a 0
转化浓度(mol/L) 0.5 1 0.5 2 4 2
平衡浓度(mol/L) 0.5 1.4 0.5 2 a-4 2
将有关数据代入平衡常数表达式,计算得a=5.4;
(3)①根据信息知,Q= c(CH3OCH3) c(H2O)/ c2(CH3OH),代入数据计算得Q=2.4,Q<K,反应正向进行,v正大于v逆;②根据平衡计算——三行式进行计算。平衡时二甲醚的物质的量浓度是1.6mol/L;
(4)以二甲醚、空气、KOH 溶液为原料,以石墨为电极可直接构成燃料电池,二甲醚发生氧化反应,在负极发生反应,根据原子守恒和电荷守恒,该电池的负极反应式为CH3OCH3 -12e-+16OH - = 2CO32-+11H2O;根据电子守恒计算析出铜的质量,2m(Cu)/64=1.12/22.4×0.5×12,m(Cu)=9.6g。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。


 ①
①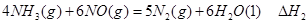 ②
② ③
③ 、
、 、
、 三者之间关系的表达式,
三者之间关系的表达式,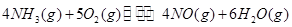
 =
=







 H= -221.0kJ/mmol
H= -221.0kJ/mmol 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 
 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。 2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1

