题目内容
7.实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2OCH2=CH2Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
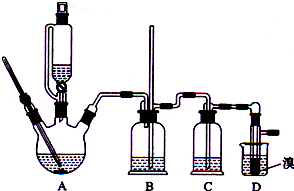
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如右:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)反应过程中A装置可能产生的酸性干扰气体SO2(填化学式),为此在装置C中应加入c(从下列选项中选择)以吸收除杂.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.高锰酸钾溶液
(3)装置B是安全瓶,其工作原理是当装置发生堵塞时,B装置中液体会压入的长玻璃导管,甚至溢出导管,以观测和缓解气压增大.
(4)若产物中有少量未反应的Br2,最好用下列试剂中的c洗涤(填选项符号),再通过分液的方法分离;
a.水 b.氢氧化钠溶液 c.NaHSO3溶液 d.苯
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
分析 本题是实验室制备1,2-二溴乙烷的实验探究题,其原理是利用乙醇和浓硫酸混合加热到170℃,通过醇的消去制得乙烯,再利用乙烯与溴的加成得到1,2-二溴乙烷,实验操作过程中要关注乙醇与浓硫酸反应的副产物SO2和CO2对实验的干扰,因为SO2能和溴水发生氧化还原反应消耗溴,另外1,2-二溴乙烷熔点低易凝结堵塞装置,同时沸点低易挥发,因此要注意控制温度,以减少产品的损失和实验操作的安全,
(1)乙醇在浓硫酸140℃的作用下发生分子间脱水;
(2)浓硫酸具有强氧化性,可能氧化乙醇中的碳,产生二氧化硫;
(3)当装置发生堵塞时,B装置中液体会压入的长玻璃导管,甚至溢出导管,以观测和缓解气压增大;
(4)Br2可以和NaHSO3溶液发生氧化还原反应;
(5)利用1,2-二溴乙烷与乙醚的沸点不同进行解答;
(6)溴易挥发,该反应放热.
解答 解:本题是实验室制备1,2-二溴乙烷的实验探究题,其原理是利用乙醇和浓硫酸混合加热到170℃,通过醇的消去制得乙烯,再利用乙烯与溴的加成得到1,2-二溴乙烷,实验操作过程中要关注乙醇与浓硫酸反应的副产物SO2和CO2对实验的干扰,因为SO2能和溴水发生氧化还原反应消耗溴,另外1,2-二溴乙烷熔点低易凝结堵塞装置,同时沸点低易挥发,因此要注意控制温度,以减少产品的损失和实验操作的安全,
(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,
故答案为:d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,反应过程中A装置可能产生的酸性干扰气体为二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,
故答案为:SO2;c;
(3)当装置发生堵塞时,B装置中液体会压入的长玻璃导管,甚至溢出导管,以观测和缓解气压增大,
故答案为:当装置发生堵塞时,B装置中液体会压入的长玻璃导管,甚至溢出导管,以观测和缓解气压增大;
(4)常温下Br2和NaHSO3溶液发生氧化还原反应,再通过分液的方法分离,故答案为:c;分液;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,故答案为:蒸馏;
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,
故答案为:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
点评 该题较为综合,主要考查了乙醇制备1,2-二溴乙烷,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | Ba(NO3)2溶液 | B. | 盐酸 | C. | 硫酸钠 | D. | 酚酞 |
| A. | 从组成上来说,Na2SO4 是钠盐、硫酸盐、正盐 | |
| B. | 氧化物不是碱性氧化物就是酸性氧化物 | |
| C. | 非金属氧化物一定是酸性氧化物 | |
| D. | 不含杂质的盐酸是纯净物 |
| A. | Cu+HNO3(浓)→Cu(NO3)2 | |
| B. | Cu+HNO3(稀)→Cu(NO3)2 | |
| C. | Cu$→_{△}^{空气}$ CuO $\stackrel{稀硝酸}{→}$Cu(NO3)2 | |
| D. | Cu $→_{△}^{浓硫酸}$CuSO4 $\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |

 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料.其常用的制备方法有两种:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料.其常用的制备方法有两种: