题目内容
12. 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料.其常用的制备方法有两种:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料.其常用的制备方法有两种:方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中.
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中.
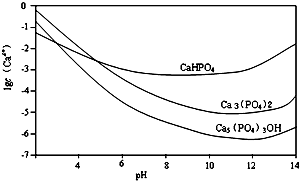
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3•H2O=Ca5(PO4)3OH↓+10NH4NO3+3H2O
②5Ca(OH)2+3H3PO4=Ca5(PO4)3OH↓+9H2O
(2)与方法A相比,方法B的优点是唯一副产物为水,工艺简单.
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是反应液局部酸性过大,会有CaHPO4产生.
(4)图中所示3种钙盐在人体中最稳定的存在形式是Ca5(PO4)3OH(填化学式).
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.结合化学平衡移动原理,分析其原因酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s)?5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿.
分析 根据原子守恒可以配平反应方程式,方法A与方法B对比,主要是A产物有副产物NH4NO3,原子利用率不高.本题后二问要利用平衡思想解决,人体pH基本上在7.39~7.41,所以钙主要存在形式为Ca5(PO4)3OH,结合其电离平衡可以分析酸会促进其电离而溶解,造成龋齿.
(1)①从守恒的角度可知,5molCa(NO3)2、3mol(NH4)2HPO4和4molNH3•H2O反应生成1molCa5(PO4)3OH、10molNH4NO3和3molH2O;
②从守恒的角度可知,5molCa(OH)2和3molH3PO4反应生成1molCa5(PO4)3OH和9molH2O;
(2)与方法A相比,方法B的优点是副产品为水,没有其它副产品,工艺简单;
(3)反应液局部酸性过大,会有CaHPO4产生;
(4)人体pH基本上在7.39~7.41,溶解度越小越稳定;
(5)根据羟基磷灰石[Ca5(PO4)3OH]电离平衡分析酸会促进其电离而溶解,造成龋齿.
解答 解:(1)①从质量守恒的角度思考,5molCa(NO3)2、3mol(NH4)2HPO4和4molNH3•H2O反应生成1molCa5(PO4)3OH、10molNH4NO3和3molH2O,反应的化学方程式为5Ca(NO3)2+3(NH4)2HPO4+4NH3•H2O=Ca5(PO4)3OH↓+10NH4NO3+3H2O
故答案为:10NH4NO3;3H2O;
②从质量守恒的角度思考,5molCa(OH)2和3molH3PO4反应生成1molCa5(PO4)3OH和9molH2O,反应的化学方程式为5Ca(OH)2+3H3PO4=Ca5(PO4)3OH↓+9H2O,
故答案为:Ca5(PO4)3OH↓+9H2O;
(2)与方法A相比,方法B的优点是副产品为水,没有其它副产品,工艺简单,
故答案为:唯一副产物为水,工艺简单;
(3)方法B中,如果H3PO4溶液滴加过快,会导致局部酸性过大,生成CaHPO4,制得的产物不纯,
故答案为:反应液局部酸性过大,会有CaHPO4产生;
(4)人体pH基本上在7.39~7.41,所以钙主要存在形式为Ca5(PO4)3OH,
故答案为:Ca5(PO4)3OH;
(5)反应平衡:Ca5(PO4)3OH(s)?5Ca2+(aq)+3PO43-(aq)+OH-(aq),酸性物质使沉淀溶解向右移动,导致Ca5(PO4)3OH溶解,造成龋齿,
故答案为:酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s)?5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿.
点评 本题考查学生对难溶电解质的溶解平衡和酸碱反应的了解,考查学生书写化学反应方程形式的能力、读图解析和方案评价能力,以及化学平衡知识的综合应用能力,题目难度中等.

| A. | 16g CH4含有4NA个电子 | |
| B. | 0.1mol铁和0.1mol铜分别与0.1mol氯气完全反应,转移的电子数均为0.2NA | |
| C. | 标准状况下,11.2L H2O中分子数为0.5NA个 | |
| D. | 0.1mol•L-1 Na2CO3溶液中含有0.2NA个Na+ |
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2OCH2=CH2Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
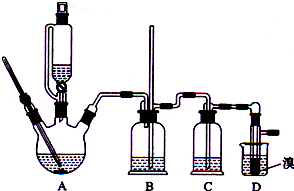
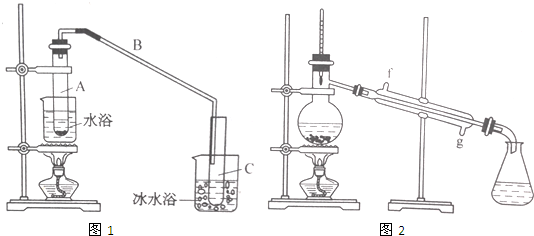
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如右:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)反应过程中A装置可能产生的酸性干扰气体SO2(填化学式),为此在装置C中应加入c(从下列选项中选择)以吸收除杂.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.高锰酸钾溶液
(3)装置B是安全瓶,其工作原理是当装置发生堵塞时,B装置中液体会压入的长玻璃导管,甚至溢出导管,以观测和缓解气压增大.
(4)若产物中有少量未反应的Br2,最好用下列试剂中的c洗涤(填选项符号),再通过分液的方法分离;
a.水 b.氢氧化钠溶液 c.NaHSO3溶液 d.苯
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
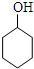 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$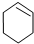 +H2O,
+H2O,| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)在不少实验中都用到水浴加热,水浴加热的特点是受热均匀,易控制加热温度,加热不超过100℃;
(2)A中瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝;
(3)试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
制备精品:
(4)环己烯粗品中含有环己醇和少量酸性杂质等.加入少量食盐水,振荡、静置、分层,环己烯在上层层(填“上”或“下”),分液后用c(填入编号)洗涤;a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液 d.溴水
(5)再将环己烯按图2装置蒸馏,冷却水从g(填字母)口进入,蒸馏时要加入生石灰,目的是除去了残留的水.
(6)收集产品时,温度应控制在83℃左右,实验值得的环己烯精品低于理论产量,可能的原因是c;
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备精品时环己醇随产品一起蒸出
(7)以下区分环己烯精品与粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
| A. | G→a→c→f→b→d→c→b | B. | G→c→b→d→c→f→c→a | C. | G→a→e→f→b→d→c | D. | G→b→f→a→d→c→b |
 的是( )
的是( )| A. | CH3-CH═CH-CH3 | B. | CH2═CH2 | ||
| C. | CH2═CCH3CH3 | D. | 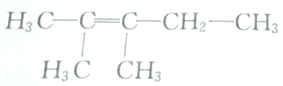 |