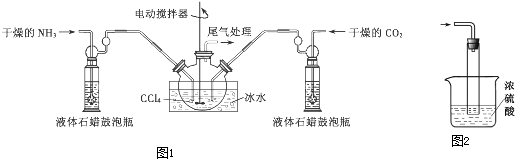
题目内容
15.明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,此外还含有少量Fe2O3杂质.利用明矾石来制备Al2O3、K2FeO4和H2SO4的工艺流程如下: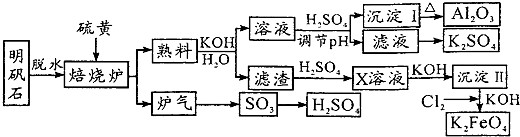
请回答下列问题:
(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S=2Al2O3+9SO2,该反应中氧化剂与还原剂的物质的量之比是2:1.若生成102g Al2O3,转移的电子数目为6NA.
(2)写出化学式:沉淀Ⅰ是Al(OH)3,沉淀Ⅱ是Fe(OH)3.
(3)熟料溶解时反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)溶液经加硫酸调节pH后,过滤、洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,则已将沉淀洗干净.
(5)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O.
(6)“焙烧”过程中生成的SO2可用于制H2SO4.已知25℃,101kPa时:
2SO2(g)+O2(g)?2SO3 (g)△H1=-197.0kJ•mol-1
H2O(g)=H2O(l)△H2=-44.0kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4 (l)△H3=-545kJ•mol-1
则SO3 (g)和H2O(l)反应的热化学方程式为SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol.
(7)本工艺流程中可循环物质为H2SO4.
分析 利用明矾石(主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,此外还含有少量Fe2O3杂质)制备Al2O3、K2FeO4和H2SO4的工艺流程:明矾脱水后主要成分是K2SO4•Al2(SO4)3•2Al2O3,“焙烧”Al2(SO4)3中+6价降低为SO2中+4价,Al2(SO4)3是氧化剂,硫单质为还原剂,发生2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$Al2O3+9SO2,熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al2O3+2OH-=2AlO2-+H2O,熟料溶解所得的溶液中含有K+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,灼烧生成Al2O3,母液中离子主要有K+、SO42-,含有溶质为K2SO4,滤渣为Fe2O3,加硫酸Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,X为Fe2(SO4)3,加氢氧化钾Fe2(SO4)3+6KOH=2Fe(OH)3↓+3K2SO4,通入氯气:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O,制得K2FeO4;
(1)所含元素化合价降低的反应物是氧化剂;反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,计算生成102gAl2O3需要硫的物质的量,转移电子是硫单质的4倍,再根据N=nNA转移电子数目;
(2)分析流程结合氧化铝的性质可知,沉淀Ⅰ是Al(OH)3;沉淀Ⅱ是Fe(OH)3;
(3)熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al2O3+2OH-=2AlO2-+H2O;
(4)沉淀Ⅰ是Al(OH)3,证明沉淀Ⅰ已洗涤干净的实验操作是检验洗涤液中师傅汉语硫酸根离子设计实验检验;
(5)氢氧化铁中通入氯气发生氧化还原反应得到K2FeO4;
(6)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(7)上述分析可知可以循环利用的物质是指参与反应过程,最后又生成的物质可以循环利用.
解答 解:利用明矾石(主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,此外还含有少量Fe2O3杂质)制备Al2O3、K2FeO4和H2SO4的工艺流程:明矾脱水后主要成分是K2SO4•Al2(SO4)3•2Al2O3,“焙烧”Al2(SO4)3中+6价降低为SO2中+4价,Al2(SO4)3是氧化剂,硫单质为还原剂,发生2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$Al2O3+9SO2,熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al2O3+2OH-=2AlO2-+H2O,熟料溶解所得的溶液中含有K+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,灼烧生成Al2O3,母液中离子主要有K+、SO42-,含有溶质为K2SO4,滤渣为Fe2O3,加硫酸Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,X为Fe2(SO4)3,加氢氧化钾Fe2(SO4)3+6KOH=2Fe(OH)3↓+3K2SO4,通入氯气:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O,制得K2FeO4;
(1)“焙烧”Al2(SO4)3中+6价降低为SO2中+4价,Al2(SO4)3是氧化剂,硫单质为还原剂,发生2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$Al2O3+9SO2,反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,反应中硫单质中硫元素化合价由0价升高为SO2中+4价,氧化剂与还原剂的物质的量之比是6:3=2:1;生成102gAl2O3的物质的量为n=$\frac{m}{M}$=$\frac{102g}{102g/mol}$=1mol,需要硫的物质的量为1mol×$\frac{3}{2}$=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为N=nNA=6mol×NAmol-1=6NA,
故答案为:2:1,6NA;
(2)分析流程结合氧化铝的性质可知,铝土矿中的氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不和氢氧化钠溶液反应过滤得到滤渣为氧化铁,熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al2O3+2OH-=2AlO2-+H2O,熟料溶解所得的溶液中含有K+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,沉淀Ⅰ是Al(OH)3,反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓,滤渣为Fe2O3,加硫酸Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,X为Fe2(SO4)3,加氢氧化钾Fe2(SO4)3+6KOH=2Fe(OH)3↓+3K2SO4,沉淀Ⅱ是Fe(OH)3,
故答案为:Al(OH)3,Fe(OH)3;
(3)熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是:取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,则已将沉淀洗干净;
故答案为:取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,则已将沉淀洗干净;
(5)Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式为:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O,
故答案为:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O;
(6)①2SO2(g)+O2(g)?2SO3 (g)△H1=-197.0kJ•mol-1
②H2O(g)=H2O(l)△H2=-44.0kJ•mol-1
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4 (l)△H3=-545kJ•mol-1
依据盖斯定律计算(③-①-②×2)$\frac{1}{2}$,则SO3 (g)和H2O(l)反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol;
(7)依据分析可知,该流程中符合能循环使用的物质为H2SO4,
故答案为:H2SO4.
点评 本题以铝、铁的化合物为载体考查了物质间的反应、物质的分离和电解等知识点,明确物质之间的反应是解本题关键,这种综合性较强的题型是高考热点,须利用基础知识细心分析解答,题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案| A. | Al3+、Na+、Cl-、H+ | B. | H+、Fe2+、ClO-、Cl- | ||
| C. | Na+、Al3+、Cl-、OH- | D. | K+、Ba2+、Cu2+、Cl- |
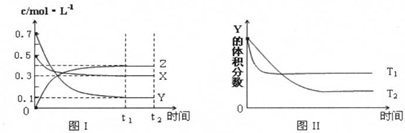
| A. | 该反应的热化学方程式为:3X(g)+Y(g)?4Z(g);△H>0 | |
| B. | 若其它条件不变,平衡后又加入一定量X,正速率增大、逆速率减小,X的转化率减小 | |
| C. | 达到平衡后,若其他条件不变,升高温度,平衡向逆反应方向移动 | |
| D. | 达到平衡后,若其他条件不变,减小容器体积,平衡不移动 |
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2OCH2=CH2Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
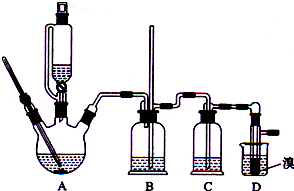
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如右:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)反应过程中A装置可能产生的酸性干扰气体SO2(填化学式),为此在装置C中应加入c(从下列选项中选择)以吸收除杂.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.高锰酸钾溶液
(3)装置B是安全瓶,其工作原理是当装置发生堵塞时,B装置中液体会压入的长玻璃导管,甚至溢出导管,以观测和缓解气压增大.
(4)若产物中有少量未反应的Br2,最好用下列试剂中的c洗涤(填选项符号),再通过分液的方法分离;
a.水 b.氢氧化钠溶液 c.NaHSO3溶液 d.苯
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
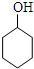 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$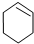 +H2O,
+H2O,| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
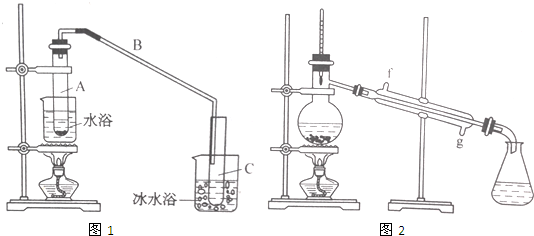
(1)在不少实验中都用到水浴加热,水浴加热的特点是受热均匀,易控制加热温度,加热不超过100℃;
(2)A中瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝;
(3)试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
制备精品:
(4)环己烯粗品中含有环己醇和少量酸性杂质等.加入少量食盐水,振荡、静置、分层,环己烯在上层层(填“上”或“下”),分液后用c(填入编号)洗涤;a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液 d.溴水
(5)再将环己烯按图2装置蒸馏,冷却水从g(填字母)口进入,蒸馏时要加入生石灰,目的是除去了残留的水.
(6)收集产品时,温度应控制在83℃左右,实验值得的环己烯精品低于理论产量,可能的原因是c;
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备精品时环己醇随产品一起蒸出
(7)以下区分环己烯精品与粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
| A. | 用蒸发皿加热NaCl溶液 | |
| B. | 不慎将汞滴落到桌面上,应立即用较多的水冲洗 | |
| C. | 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| D. | 用瓷坩埚熔化氢氧化钠 |