题目内容
16.胆矾(CuSO4•5H2O)是铜的重要化合物,有着广泛的应用.以下是CuSO4•5H2O的实验室制备流程图.
完成下列各题:
Ⅰ.(1)向含铜粉的稀硫酸中滴加浓硝酸,随着铜粉的溶解可能观察到的实验现象溶液呈蓝色、有红棕色气体生成.
(2)制得的胆矾晶体(CuSO4•5H2O)中可能存在的杂质是Cu(NO3)2(写化学式).
(3)采用重量法测定CuSO4•5H2O的含量时,步骤如下:
①取样,称量 ②加水溶解 ③加氯化钡溶液生成沉淀 ④过滤(其余步骤省略)在过滤前,需要检验是否沉淀完全,其操作是向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全.
Ⅱ.某研究性学习小组用ZRY-1型热重分析仪对12.5克硫酸铜晶体(CuSO4•5H2O)进行热重分析,随温度的升高,硫酸铜晶体依次发生下列反应.
a.CuSO4•5H2O$\frac{\underline{\;258℃\;}}{\;}$CuSO4+5H2O b.CuSO4$\frac{\underline{\;650℃\;}}{\;}$CuO+SO3↑,2SO3$\stackrel{△}{?}$2SO2+O2
c.4CuO$\frac{\underline{\;1000℃\;}}{\;}$2Cu2O+O2↑
请回答下列问题:
(4)①实验过程中热重分析仪测得残留固体质量为3.8g,试推断该固体的组分是CuO与Cu2O(写化学式),其对应的物质的量之比是2:1.
②热重分析仪加热晶体至恒重后,将全部气体导出,通入氢氧化钡溶液充分反应,所得沉淀经过滤、洗涤、干燥,质量为11.65g.
分析 (1)铜与浓硝酸反应有硝酸铜和红棕色的二氧化氮产生,根据反应的产物判断现象;
(2)制硫酸铜时,用铜与硝酸、硫酸的混合物反应的,所以可根据反应物判断可能存在的杂质;
(3)需要检验是否沉淀完全,可以通过检验溶液中是否有硫酸根离子判断,可以向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全;
(4)①根据题中反应的方程式可知,最后残留的固体应为氧化铜或氧化亚铜或两者的混合物,根据铜元素守恒列方程组可求得混合的组成及物质的量之比;
②根据硫元素质量守恒定律可知生成三氧化硫、二氧化硫的总物质的量为硫酸铜晶体的物质的量,三氧化硫、二氧化硫、氧气混合气体与氢氧化钡生成硫酸钡沉淀,据此计算出沉淀质量.
解答 解:(1)铜与浓硝酸反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成硫酸铜和二氧化氮气体,观察到溶液呈蓝色、有红棕色气体生成,
故答案为:溶液呈蓝色;有红棕色气体生成;
(2)制硫酸铜时,用铜与硝酸、硫酸的混合物反应的,铜与硝酸能生成硝酸铜,所以可能混有硝酸铜杂质,化学式为Cu(NO3)2,
故答案为:Cu(NO3)2;
(3)需要检验是否沉淀完全,可以通过检验溶液中是否有硫酸根离子判断,可以向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全,
故答案为:向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全;
(4)①根据题中反应的方程式可知,最后残留的固体应为氧化铜或氧化亚铜或两者的混合物,设氧化铜的物质的量为xmol,氧化亚铜的物质的量为ymol,根据题意$\left\{\begin{array}{l}{(x+2y)×250=12.5}\\{80x+144y=3.8}\end{array}\right.$,解得x=$\frac{1}{40}$,y=$\frac{1}{80}$,所以CuO与Cu2O的物质的量之比为2:1,
故答案为:CuO与Cu2O;2:1;
②能够与氢氧化钡反应的气体为二氧化硫,根据反应方程式CuSO4$\frac{\underline{\;650℃\;}}{\;}$CuO+SO3↑,2SO3$\stackrel{△}{?}$2SO2+O2 可知,生成二氧化硫的物质的量等于硫酸铜的物质的量,可以分解生成三氧化硫、二氧化硫的物质的量为0.05mol,三氧化硫、二氧化硫、氧气与氢氧化钡溶液反应生成0.05mol硫酸钡,生成硫酸钡的质量为233g/mol×0.05mol=11.65g,
故答案为:11.65.
点评 本题考查了物质含量的测定、实验现象等观察、实验原理的分析等,题目难度中等,侧重于考查学生的实验探究能力和计算能力.

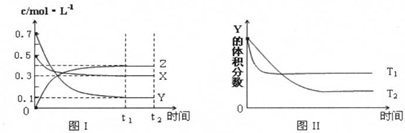
| A. | 该反应的热化学方程式为:3X(g)+Y(g)?4Z(g);△H>0 | |
| B. | 若其它条件不变,平衡后又加入一定量X,正速率增大、逆速率减小,X的转化率减小 | |
| C. | 达到平衡后,若其他条件不变,升高温度,平衡向逆反应方向移动 | |
| D. | 达到平衡后,若其他条件不变,减小容器体积,平衡不移动 |
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2OCH2=CH2Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
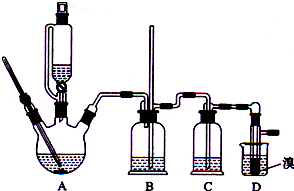
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如右:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)反应过程中A装置可能产生的酸性干扰气体SO2(填化学式),为此在装置C中应加入c(从下列选项中选择)以吸收除杂.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.高锰酸钾溶液
(3)装置B是安全瓶,其工作原理是当装置发生堵塞时,B装置中液体会压入的长玻璃导管,甚至溢出导管,以观测和缓解气压增大.
(4)若产物中有少量未反应的Br2,最好用下列试剂中的c洗涤(填选项符号),再通过分液的方法分离;
a.水 b.氢氧化钠溶液 c.NaHSO3溶液 d.苯
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
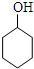 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$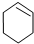 +H2O,
+H2O,| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
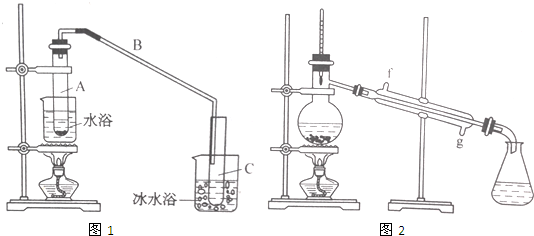
(1)在不少实验中都用到水浴加热,水浴加热的特点是受热均匀,易控制加热温度,加热不超过100℃;
(2)A中瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝;
(3)试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
制备精品:
(4)环己烯粗品中含有环己醇和少量酸性杂质等.加入少量食盐水,振荡、静置、分层,环己烯在上层层(填“上”或“下”),分液后用c(填入编号)洗涤;a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液 d.溴水
(5)再将环己烯按图2装置蒸馏,冷却水从g(填字母)口进入,蒸馏时要加入生石灰,目的是除去了残留的水.
(6)收集产品时,温度应控制在83℃左右,实验值得的环己烯精品低于理论产量,可能的原因是c;
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备精品时环己醇随产品一起蒸出
(7)以下区分环己烯精品与粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
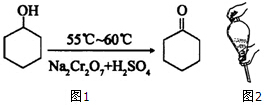 环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1:
环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1:环己醇和环己酮的部分物理性质见下表:
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分提纯步骤的正确顺序是d b e c a.
(2)b中水层用乙醚萃取的目的是使水层中残留有机物进一步被提取,提高产品产量.
(3)以下关于萃取分液操作的叙述中,不正确的是ABC.
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图2用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度,增加水层的密度,有利于分层.
(5)蒸馏除乙醚的操作中采用的加热方式为水浴加热.收集产品时,实验制得的环己酮质量低于理论产量,可能的原因是C
A.蒸馏时从151℃开始收集产品 B.环己醇实际用量过多 C.制备粗品时环己醇有损失
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60.3%.(保留小数点后1位数)
| A. | G→a→c→f→b→d→c→b | B. | G→c→b→d→c→f→c→a | C. | G→a→e→f→b→d→c | D. | G→b→f→a→d→c→b |
| A. | 用蒸发皿加热NaCl溶液 | |
| B. | 不慎将汞滴落到桌面上,应立即用较多的水冲洗 | |
| C. | 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| D. | 用瓷坩埚熔化氢氧化钠 |
 .在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ ClO-+H2↑;.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.
.在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ ClO-+H2↑;.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.