题目内容
下列有关反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H(298K)=-905kJ?mol-1的描述正确的是( )
| A、生成物的总能量大于反应物的总能量 |
| B、该反应为放热反应 |
| C、该反应中每4 mol NH3(g)被氧化,吸收905 kJ热量 |
| D、该反应为吸热反应 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:△H<0,正反应放热,反应物总能量大于生成物总能量,每有4 mol NH3(g)被氧化,放出905KJ的热量,据此解答.
解答:
解:A、反应物总能量大于生成物,故A错误;
B、△H<0,正反应放热,故B正确;
C、每有4 mol NH3(g)被氧化,放出905KJ的热量,故C错误;
D、△H<0,正反应放热,故D错误;
故选:B.
B、△H<0,正反应放热,故B正确;
C、每有4 mol NH3(g)被氧化,放出905KJ的热量,故C错误;
D、△H<0,正反应放热,故D错误;
故选:B.
点评:本题考查了热化学方程式的意义和表示方法,反应焓变的分析判断,题目较简单.

练习册系列答案
相关题目
将乙炔通入苯和甲醛形成混合溶液,测得此混合溶液中碳的质量分数为a,则该混合物中氧的质量分数为( )
A、1-
| ||||
B、1-
| ||||
C、
| ||||
D、
|
下列物质中,只含有离子键的化合物是( )
| A、KOH |
| B、NH4Cl |
| C、HCl |
| D、MgCl2 |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断.下列说法不合理的是( )
| A、由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| B、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| C、在元素周期表中,硅、锗都位于金属与非金属的交界处,都可以作半导体材料 |
| D、Cs和Ba分别位于第六周期ⅠA族和ⅡA族,碱性:CsOH>Ba(OH)2 |
下列反应的离子方程式不正确的是( )
| A、碳酸氢钙溶液加入过量的氢氧化钙溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| B、等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++OH-═NH3?H2O |
| C、在含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
| D、等体积同浓度NaHSO4、Ba(OH)2两溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
X、Y两元素是同一周期的非金属元素,如果X的原子半径比Y大.下面叙述正确的是( )
| A、X的最高价氧化物对应的水化物的酸性比Y的强 |
| B、X的非金属性比Y的强 |
| C、X的阴离子与Y的阴离子具有相同的电子层排布 |
| D、X的气态氢化物比Y的稳定 |
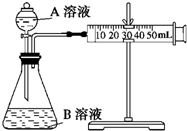 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.