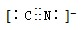题目内容
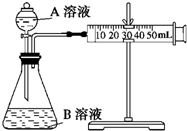 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.(1)该反应的离子方程式为
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
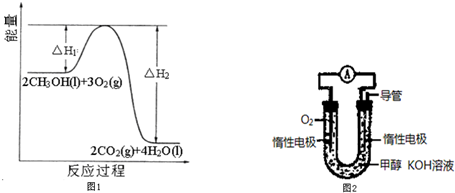
实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③ | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液和少量MnSO4 |
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.
取两支试管各加入2mL 0.1mol/L H2C2O4溶液,另取两支试管各加入4mL 0.1mol/L KMnO4溶液.将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究
考点:探究温度、压强对化学反应速率的影响
专题:实验设计题
分析:(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大;
对比②③实验可探究催化剂对化学反应速率的影响,③中使用了催化剂;
(3)草酸和高锰酸钾反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,分析数据可知高锰酸钾过量.
(2)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大;
对比②③实验可探究催化剂对化学反应速率的影响,③中使用了催化剂;
(3)草酸和高锰酸钾反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,分析数据可知高锰酸钾过量.
解答:
(1)故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大,
对比②③实验可探究催化剂对化学反应速率的影响,③中使用了催化剂,故相同时间内③实验中所得二氧化碳最多,
故答案为:③>②>①.
(3)草酸和高锰酸钾反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
草酸的物质的量为:0.002L×0.1mol?L-1=2×10-4mol,
高锰酸钾的物质的量为:0.004L×0.1mol?L-1=4×10-4mol,
由方程式可知,高锰酸钾过量,故没看到溶液完全褪色,
故答案为:温度,没有加入稀硫酸酸化.
(2)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大,
对比②③实验可探究催化剂对化学反应速率的影响,③中使用了催化剂,故相同时间内③实验中所得二氧化碳最多,
故答案为:③>②>①.
(3)草酸和高锰酸钾反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
草酸的物质的量为:0.002L×0.1mol?L-1=2×10-4mol,
高锰酸钾的物质的量为:0.004L×0.1mol?L-1=4×10-4mol,
由方程式可知,高锰酸钾过量,故没看到溶液完全褪色,
故答案为:温度,没有加入稀硫酸酸化.
点评:本题考查了影响化学反应速率的因素,难度不大,注意可通过KMnO4和草酸反应的方程式来判断量的多少.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
若溶液中由水电离产生的c(OH-)=1×10-13mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
| A、Al3+、Na+、NO3-、Cl- |
| B、K+、Na+、Cl-、SO42- |
| C、K+、Na+、Cl-、CO32- |
| D、K+、I-、NO3-、Cl- |
向含有NaBr和KI的混合溶液中通入氯气充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体可能是( )
| A、NaCl和KI |
| B、NaCl和I2 |
| C、KCl和NaBr |
| D、KCl和I2 |
工业生产中常将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物--合金.这是制取合金的常用方法之一.根据下表数据判断,不宜用上述方法制取合金的是( )
| 金属 | Na | Al | Cu | Fe |
| 熔点(℃) | 97.81 | 660 | 1083 | 1535 |
| 沸点(℃) | 883 | 2200 | 2595 | 3000 |
| A、Fe-Cu合金 |
| B、Cu-Al合金 |
| C、Al-Na合金 |
| D、Cu-Na合金 |
下列有关反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H(298K)=-905kJ?mol-1的描述正确的是( )
| A、生成物的总能量大于反应物的总能量 |
| B、该反应为放热反应 |
| C、该反应中每4 mol NH3(g)被氧化,吸收905 kJ热量 |
| D、该反应为吸热反应 |
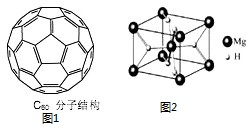 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.