题目内容
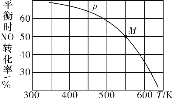
【题目】向恒温恒压容器中充入2 mol NO、1 mol O2,发生反应:2NO(g)+O2(g)![]() 2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
A.NO与O2的物质的量的比值不再改变B.混合气体的颜色不再改变
C.容器体积不再改变D.混合气体的密度不再改变
【答案】A
【解析】
A. 充入2 mol NO、1 mol O2,发生反应:2NO(g)+O2(g)![]() 2NO2(g),所以NO与O2的物质的量的比值一直不变,不能据此判断反应是否处于平衡状态,A符合题意;
2NO2(g),所以NO与O2的物质的量的比值一直不变,不能据此判断反应是否处于平衡状态,A符合题意;
B. 混合气体的颜色不再改变,说明二氧化氮的浓度不变,反应达平衡状态,B不符合题意;
C. 容器体积不再改变,说明气体的物质的量不变,正、逆反应速率相等,反应达平衡状态,C不符合题意;
D. 混合气体的密度不再改变,由于气体的质量始终不变,说明气体的体积不变,反应达平衡状态,D不符合题意;
故合理选项是A。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】下表中对应关系正确的是( )
A | CH3CH3+Cl2 CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
B | 由油脂得到甘油;由卤代烃制醇 | 均发生了水解反应 |
C | Cl2+2Br→2Cl+Br2;Zn+Cu2+→Zn2++Cu | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O→4NaOH+O2↑; 2F2+2H2O→4HF+ O2 | 均为水作还原剂的氧化还原反应 |
A.AB.BC.CD.D
【题目】下表为元素周期表的短周期部分。
a | |||||||
b | c | d | |||||
e | f | g | h |
请参照元素a-h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有 _____ 种不同伸展方向的电子云,最外层共有 _____ 种不同运动状态的电子。
(2)比较d、e元素常见离子的半径大小(用化学式表示)_______>__________;b、c 两元素非金属性较强的是(写元素符号)________,写出证明这一结论的一个化学方程式 ___________________ 。
(3)d、e元素形成的四原子化合物的电子式为___________;b、g元素形成的分子bg2为__________分子(填写“极性”或“非极性”)。
(4)上述元素可组成盐R:ca4f(gd 4)2和盐S:ca4agd4 ,相同条件下,0.1 mol/L 盐R中c(ca4+)________(填“等于”、“大于”或“小于”)0.1 mol/L 盐S中c(ca4+)。
(5)向盛有10mL1 mol/L盐S溶液的烧杯中滴加1 mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是 __________________________________________ 。
(6)向盛有10mL 1 mol/L盐 R溶液的烧杯中滴加1 mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL—35mL)间发生的离子方程式: _________________________ 。若在10mL 1 mol/L 盐R溶液的烧杯中加20mL1.2 mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
【题目】CO和H2可作为能源和化工原料,应用十分广泛。常利用煤气化过程中生成的CO和H2来制备甲醇。
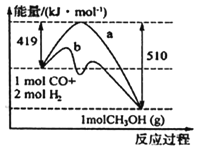
(1)请根据图示写出该反应的热化学方程式:_______________;图中使用催化剂曲线是_______(填“a”或“b”)。
(2)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的ΔH=______________kJ/mol。
(3)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为___________________。
(4)汽车排气管上的催化转化器发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A. 2v正(NO)=v逆(N2) B. 混合气体的平均相对分子质量保持不变
C. 气体总压强不再变化 D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5 min,生成了0.08 mol N2,则5 min内v(CO)=__________mol/(L·min)。
③25 min时,物质浓度变化如图所示,则改变的条件可能是________(填字母标号)。
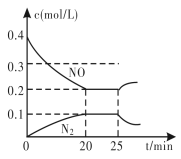
A. 缩小容器体积 B. 增加NO的浓度
C. 降低温度 D. 升高温度