题目内容
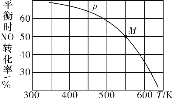
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂。可通过以下反应制得:2NO(g)+Cl2(g)![]() 2ClNO(g)。按投料比[n(NO):n(Cl2)]=2:1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率 与温度T、压强p(总压)的关系如图所示:
2ClNO(g)。按投料比[n(NO):n(Cl2)]=2:1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率 与温度T、压强p(总压)的关系如图所示:
(1)该反应的△H____(填“>”“<”或“=”)0。
(2)在压强为p条件下,M点时容器内NO的体积分数为_______。
(3)若反应一直保持在p=b Pa压强条件下进行,则M点的分压平衡常数Kp=________(用含b的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(4)实验测得,v正=k正·c2(NO)·c(Cl2),v逆=k逆·c2(ClNO)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol Cl2和1 mol NO,在一定温度下达到平衡时,NO的转化率为40%,则k正:k逆=________。(保留一位小数)
【答案】< 40% ![]() Pa-1 < 1.1
Pa-1 < 1.1
【解析】
(1)根据图象,升高温度,NO的转化率减小,说明平衡逆向移动,正反应为放热反应;
(2)由差量法进行计算,根据2NO(g)+Cl2(g)=2ClNO(g)可知,气体减小的物质的量为反应的NO的物质的量的一半;
(3)设NO的物质的量为2mol,则Cl2的物质的量为1mol,列三段式求解平衡K;
(4)①结合温度对反应速率的影响回答;
②平衡时v正=v逆,则k正c2(NO)C(Cl2)=k逆C2(ClNO),则![]() =K,已知起始量1molCl2和1mol NO,NO的转化率为40%,列三段式求解。
=K,已知起始量1molCl2和1mol NO,NO的转化率为40%,列三段式求解。
(1)根据图象,升高温度,NO的转化率减小,说明平衡逆向移动,说明该反应正反应为放热反应,△H<0;
(2)根据图象,在压强为P条件下,M点时容器内NO的转化率为50%,根据2NO(g)+Cl2(g)=2ClNO(g)可知,气体减小的物质的量为反应的NO的物质的量的一半,因此NO的体积分数为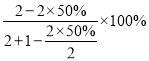 =40%;
=40%;
(3)设NO的物质的量为2mol,则Cl2的物质的量为1mol,列三段式如下:
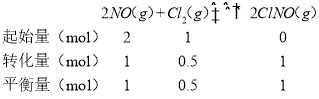
平衡常数K=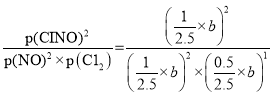
![]() =
=![]() Pa-1;
Pa-1;
(4)①平衡时正逆反应速率相等,温度升高,正逆反应速率增大,即k正、k逆均增大,因为反应放热,平衡逆向移动,所以k逆比k正增大多;
②已知起始量1molCl2和1mol NO,NO的转化率为40%,则c(NO)=1mol÷2L=0.5mol/L,c(Cl2)=1mol÷2L=0.5mol/L,△c(NO)=0.5mol/L×40%=0.2mol/L,列三段式如下:

平衡常数K=![]() =1.1(mol/L)-1,平衡时v正=v逆,则k正c2(NO)c(Cl2)=k逆c2(ClNO),则
=1.1(mol/L)-1,平衡时v正=v逆,则k正c2(NO)c(Cl2)=k逆c2(ClNO),则![]() =K=1.1(mol/L)-1。
=K=1.1(mol/L)-1。

 53随堂测系列答案
53随堂测系列答案