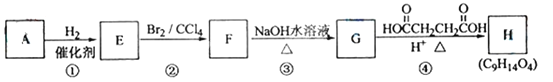
题目内容
【题目】CO和H2可作为能源和化工原料,应用十分广泛。常利用煤气化过程中生成的CO和H2来制备甲醇。
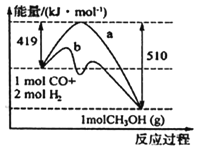
(1)请根据图示写出该反应的热化学方程式:_______________;图中使用催化剂曲线是_______(填“a”或“b”)。
(2)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的ΔH=______________kJ/mol。
(3)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为___________________。
(4)汽车排气管上的催化转化器发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A. 2v正(NO)=v逆(N2) B. 混合气体的平均相对分子质量保持不变
C. 气体总压强不再变化 D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5 min,生成了0.08 mol N2,则5 min内v(CO)=__________mol/(L·min)。
③25 min时,物质浓度变化如图所示,则改变的条件可能是________(填字母标号)。
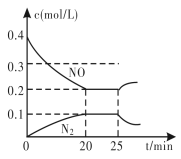
A. 缩小容器体积 B. 增加NO的浓度
C. 降低温度 D. 升高温度
【答案】CO(g)+2H2(g)=CH3OH(g) △H=-91 kJ/mol b -524.8 放 50% BC 0.016 mol/(L·min) D
【解析】
(1)根据反应物与生成物的总能量来分析吸热还是放热,并书写热化学反应方程式,催化剂降低反应活化能,但不改变反应热效应;
(2)根据①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol;
②C(s)+H2O(g)=CO(g)+H2(g) △H3=+131.3 kJ/mol;
利用盖斯定律,将①-②可得反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的反应热;
(3)①平衡常数随温度升高减小,说明升高温度,化学平衡逆向进行,逆反应是吸热反应,则该反应的正反应是放热反应;
②依据830℃的化学平衡常数的数值,结合平衡常数的含义计算一氧化碳的转化率;
(4)①根据平衡状态的特征是动态平衡,各物质的量不再随时间变化而变化,据此逐一分析判断;
②从反应开始到5 min,生成了N2 0.08 mol,CO的变化量是0.08 mol×2=0.16 mol,则5 min 内根据v(CO)=![]() 计算;
计算;
③平衡时一氧化碳的浓度增大,平衡向逆反应方向移动,
A.缩小容器体积平衡向正反应方向移动;
B.增增加NO的浓度平衡向正反应方向移动;
C.降低温度平衡向正反应方向移动;
D.升高温度平衡向逆反应方向移动。
(1)反应物的总能量为419 kJ,生成物的总能量为510 kJ,则该反应为放热反应,放出的热量为419 kJ-510 kJ=-91 kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g) △H=-91 kJ/mol;曲线b降低了反应活化能,应该是反应使用了催化剂,故合理选项是b;
(2)根据①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol;
②C(s)+H2O(g)=CO(g)+H2(g) △H3=+131.3kJ/mol,
利用盖斯定律,将①-②可得反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),△H=-393.5kJ/mol-131.3kJ/mol=-524.8 kJ/mol;
(3)①根据图表中平衡常数K与温度的关系,可知:温度升高化学平衡常数减小,说明升高温度,平衡逆向移动,逆反应是吸热反应,则该反应的正反应是放热反应;
②在830℃,平衡常数K=1,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,设反应达到平衡一氧化碳反应物质的量为x,则根据方程式式中物质转化关系可知平衡时各种气体的物质的量n(CO)=n(H2O)=1-x,n(H2)=n(CO2)=x,![]() =1,解得x=0.5 mol,所以达到平衡后CO的转化率=
=1,解得x=0.5 mol,所以达到平衡后CO的转化率=![]() ×100%=50%;
×100%=50%;
(4)①A.该反应达到平衡状态时应有v正(NO)=2v逆(N2),A错误;
B.混合气体的相对分子质量不变,说明气体的总物质的量不变,反应达平衡状态,B正确;
C.气体总压强不变,说明气体的总物质的量不变,反应达平衡状态,C正确;
D.△H只与具体热化学方程式有关,与反应物的量的变化无关,无法判断反应达到平衡状态,D错误;
E.混合气体的体积和质量始终不变,因此混合气体的密度也始终不变,因此不能根据密度不再变化,判断反应是否达到平衡状态,E错误;
故合理选项是BC;
②从反应开始到5 min,生成了N2 0.08 mol,则5 min 内v(CO)= ×2=0.016 mol/(L·min);
×2=0.016 mol/(L·min);
③反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0的正反应为气体体积减小的放热反应,根据图象可知:平衡时一氧化氮的浓度增大,N2的浓度减小,平衡向逆反应方向移动。
N2(g)+2CO2(g) △H<0的正反应为气体体积减小的放热反应,根据图象可知:平衡时一氧化氮的浓度增大,N2的浓度减小,平衡向逆反应方向移动。
A.缩小容器体积,化学平衡向正反应方向移动,A不符合题意;
B.增加NO的浓度平衡,化学平衡向正反应方向移动,B不符合题意;
C.降低温度,化学平衡向正反应方向移动,C不符合题意;
D.升高温度,化学平衡向吸热的逆反应方向移动,D符合题意;
故合理选项是D。

 天天练口算系列答案
天天练口算系列答案