题目内容
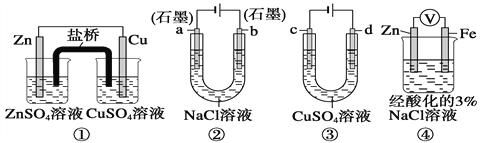
【题目】下表为元素周期表的短周期部分。
a | |||||||
b | c | d | |||||
e | f | g | h |
请参照元素a-h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有 _____ 种不同伸展方向的电子云,最外层共有 _____ 种不同运动状态的电子。
(2)比较d、e元素常见离子的半径大小(用化学式表示)_______>__________;b、c 两元素非金属性较强的是(写元素符号)________,写出证明这一结论的一个化学方程式 ___________________ 。
(3)d、e元素形成的四原子化合物的电子式为___________;b、g元素形成的分子bg2为__________分子(填写“极性”或“非极性”)。
(4)上述元素可组成盐R:ca4f(gd 4)2和盐S:ca4agd4 ,相同条件下,0.1 mol/L 盐R中c(ca4+)________(填“等于”、“大于”或“小于”)0.1 mol/L 盐S中c(ca4+)。
(5)向盛有10mL1 mol/L盐S溶液的烧杯中滴加1 mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是 __________________________________________ 。
(6)向盛有10mL 1 mol/L盐 R溶液的烧杯中滴加1 mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL—35mL)间发生的离子方程式: _________________________ 。若在10mL 1 mol/L 盐R溶液的烧杯中加20mL1.2 mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
【答案】4 7 O2- Na+ N 2HNO3+Na2CO3 = 2NaNO3+ CO2↑ + H2O ![]() 非极性 小于 c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) NH4+ + OH- = NH3+H2O 0.022
非极性 小于 c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) NH4+ + OH- = NH3+H2O 0.022
【解析】
由元素在周期表中位置可知,a为H、b为C、c为N、d为O、e为Na、f为Al、g为S、h为Cl。
(1)h为Cl原子核外电子排布为1s22s22p63s23p5,只有s、p轨道电子云;核外没有运动状态相同的电子;
(2)电子层结构相同的离子,核电荷数越大离子半径越小;
同周期自左而右元素非金属性增强,可以利用最高价含氧酸中强酸制备弱酸进行验证;
(3)d、e元素形成的四原子化合物为Na2O2;b、g元素形成的分子SC2为直线型对称结构;
(4)NH4Al(SO4)2溶液中铵根离子与铝离子相互抑制水解,而NH4HSO4溶液中氢离子抑制铵根离子水解,铝离子抑制程度不如酸的抑制程度大;
(5)NH4HSO4与NaOH按物质的量1:1反应时为硫酸钠、硫酸铵混合溶液,溶液呈酸性,二者混合呈中性,还有一水合氨生成,为硫酸钠、硫酸铵、一水合氨混合溶液;
(6)根据n=cV计算n(Al3+)、n(NH4+)、n(SO42-),开始发生反应:Al3++3OH-=Al(OH)3↓,再发生反应:NH4++OH-=NH3H2O,最后发生反应:Al(OH)3+OH-=AlO2-+2H2O,根据离子方程式计算判断加入32mLNaOH溶液后,继续滴加至35mL时反应离子方程式;计算n(Ba2+)、n(OH-),根据SO42-、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3H2O、Al(OH)3+OH-=AlO2-+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量。
(1)h为Cl原子核外电子排布为1s22s22p63s23p5,只有s、p轨道电子云,有4种伸展方向不同的电子,核外子没有运动状态相同的电子,最外层有7种运动状态不同的电子,故答案为:4;7;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+,同周期自左而右元素非金属性增强,故非金属性N>C,可以利用最高价含氧酸中强酸制备弱酸进行验证,反应方程式为:2HNO3+Na2CO3=2NaNO3+CO2↑+H2O,故答案为:O2->Na+;N;2HNO3+Na2CO3=2NaNO3+CO2↑+H2O;
(3)d、e元素形成的四原子化合物为Na2O2,电子式为:![]() ,b、g元素形成的分子SC2为直线型对称结构,分子中正负电荷重心重合,属于非极性分子,故答案为:
,b、g元素形成的分子SC2为直线型对称结构,分子中正负电荷重心重合,属于非极性分子,故答案为:![]() ;非极性;
;非极性;
(4)NH4Al(SO4)2溶液中铵根离子与铝离子相互抑制水解,而NH4HSO4溶液中氢离子抑制铵根离子水解,铝离子抑制程度不如酸的抑制程度大,则NH4HSO4溶液中铵根离子浓度更大,故答案为:小于;
(5)NH4HSO4与 NaOH按物质的量1:1反应时为硫酸钠、硫酸铵混合溶液,溶液呈酸性,二者混合呈中性,还有一水合氨生成,为硫酸钠、硫酸铵、一水合氨混合溶液,则反应后各离子浓度由大到小的排列顺序是:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
(6)10mL 1molL-1NH4Al(SO4)2溶液中Al3+物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,32mL 1mol/L NaOH溶液中NaOH物质的量为0.032L×1mol/L=0.032mol,由Al3++3OH-=Al(OH)3↓,可知完全沉淀铝离子消耗0.03mol NaOH,消耗NaOH溶液30mL,由NH4++OH-=NH3H2O,可知铵根离子完全反应消耗NaOH为0.01mol,又消耗NaOH溶液10mL,故加入32mLNOH溶液后,继续滴加至35mL时反应离子方程式为:NH4++OH-=NH3H2O; 20mL 1.2 molL-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,根据Al3++3OH-=Al(OH)3↓,0.01mol Al3+消耗0.03molOH-,生成0.01mol Al(OH)3,反应剩余OH-为0.048mol-0.03mol=0.018mol,0.01mol NH4+消耗0.01mol OH-,反应剩余OH-为0.018mol-0.01mol=0.008mol,根据Al(OH)3+OH-=AlO2-+2H2O,0.008molOH-溶解0.008mol Al(OH)3,故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol,则最终得到固体为0.02mol+0.002mol=0.022mol,故答案为:NH4++OH-=NH3H2O;0.022。