题目内容
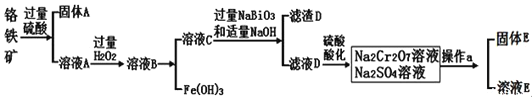
【题目】铋酸钠(NaBiO3)常用作Mn2+鉴定的强氧化剂,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2等杂质)制备铋酸钠,其流程如图:
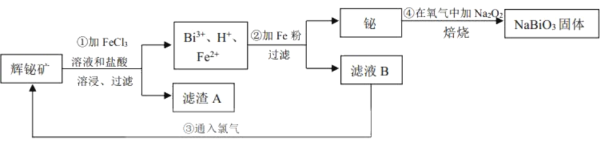
己知:①NaBiO3是一种难溶于水的物质
②BiCl3极易水解生成不溶性的BiOCl沉淀
请回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有___(填标号)。
a.加入足量的蒸馏水 b.搅拌 c.粉碎矿石 d.降低温度
(2)溶浸时通常加入FeCl3溶液和浓盐酸,加入的浓盐酸需过量的目的是___,滤渣A的主要成分为___(填化学式)。
(3)反应④的化学方程式为___。
(4)NaBiO3可在酸性介质中将Mn2+氧化为MnO![]() ,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为___。
,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为___。
(5)实验室为了测定NaBiO3样品的纯度,需要配制250mL0.500mol/LFeSO4溶液,所需要的玻璃仪器除烧杯、量筒、玻璃棒外,还需要___。
(6)取上述NaBiO3样品10.0g,加入稀硫酸和MnSO4溶液使其完全溶解,稀释至100mL,取出20.00mL溶液,然后用新配制的0.500mol/LFeSO4溶液进行滴定,滴定完成后消耗24.80mLFeSO4溶液。则该样品中NaBiO3纯度为___%(结果保留小数点后一位)。
【答案】bc 防止FeCl3及BiCl3水解,提高原料的浸出率 SiO2、S 2Bi+Na2O2+2O2![]() 2NaBiO3 5NaBiO3+2Mn2++14H+=2
2NaBiO3 5NaBiO3+2Mn2++14H+=2![]() +5Na++5Bi3++7H2O 250mL容量瓶、胶头滴管 86.8
+5Na++5Bi3++7H2O 250mL容量瓶、胶头滴管 86.8
【解析】
本实验利用辉铋矿制备铋酸钠,首先向辉铋矿中加入氯化铁溶液和盐酸,使Bi全部变为Bi3+,矿石中的SiO2不溶于溶液、S离子变为单质,滤渣A的主要成分是SiO2和S;随后向含有Bi3+的溶液中加入铁粉,由于Fe的活动性强于Bi,可以将Bi3+还原为Bi单质,Bi单质与过氧化钠在空气中焙烧即得到铋酸钠固体。
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有搅拌、粉碎矿石、升高温度等,所以正确的选项是bc;
(2)FeCl3和BiCl3都是强酸弱碱盐,Fe3+、Bi3+会发生水解反应形成Fe(OH)3、Bi(OH)3等不溶性沉淀,溶浸时通常加入FeCl3溶液和浓盐酸,向其中加入过量浓盐酸的目的是防止FeCl3及BiCl3水解生成不溶性沉淀,提高原料的浸出率;酸性氧化物SiO2不能与酸发生反应,在加入FeCl3溶液时会发生氧化还原反应:S2-+2Fe3+=S↓+2Fe2+,产生的S单质难溶于水,也以沉淀的形式存在,所以得到的滤渣成分是S、SiO2;
(3)Bi和过氧化钠在空气中焙烧,生成铋酸钠,反应方程式为2Bi+Na2O2+2O2![]() 2NaBiO3;
2NaBiO3;
(4)铋酸钠可在酸性介质中将Mn2+氧化为![]() ,则根据电子守恒、电荷守恒及原子守恒,NaBiO3被还原为Bi3+的离子方程式是5NaBiO3+2Mn2++14H+=2
,则根据电子守恒、电荷守恒及原子守恒,NaBiO3被还原为Bi3+的离子方程式是5NaBiO3+2Mn2++14H+=2![]() +5Na++5Bi3++7H2O;
+5Na++5Bi3++7H2O;
(5)实验室为了测定NaBiO3样品的纯度,需要配制250mL 2.0mo1·L-1FeSO4溶液,所需要的玻璃仪器除烧杯、量筒、玻璃棒外,还需要250mL容量瓶、胶头滴管;
(6)根据在氧化还原反应中电子转移数目相等可得关系式:NaBiO3~2FeSO4,n(FeSO4)=2.0mo1·L-1×0.031L=0.062mol,则n(NaBiO3)=0.031mol,所以该样品中NaBiO3纯度为![]() =86.8%。
=86.8%。