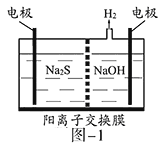
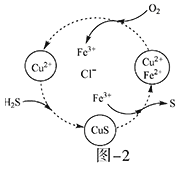
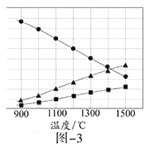
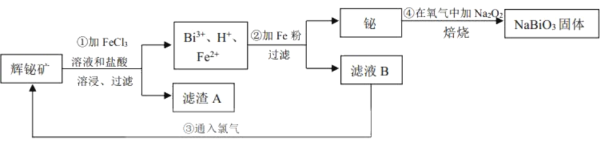
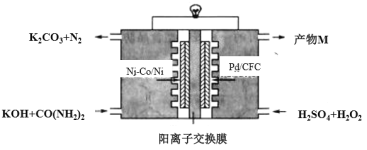
题目内容
【题目】常温下,向20mL0.1mol/L NaHA(酸式盐)溶液中分别滴加0.1mol/L 盐酸或0.1mol/L NaOH溶液,溶液的pH与滴加溶液体积关系如图所示。下列推断正确的是( )
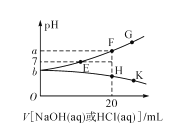
A.NaHA在水中电离程度大于水解程度
B.在对应的各点溶液中,H点水电离程度最大
C.E点对应的溶液中有c(Na+)=c(HA-)+c(A2-)
D.F点对应的溶液中存在c(H+)+c(Na+)=(OH-)+c(HA-)+c(A2-)
【答案】A
【解析】
A.由图示可知,常温下,0.1mol/L NaHA溶液的pH<7,显酸性,说明HA-的电离程度大于HA-的水解程度,故A正确;
B.图中F点恰好生成Na2A溶液,只存在A2-的水解,水的电离程度最大,而H点恰好生成H2A和NaCl的混合液,H2A的电离抑制水的电离,水的电离程度小,故B错误;
C.E点溶液中存在的电荷守恒式为c(Na+)+ c(H+)= c(OH-)+c(HA-)+2c(A2-),此时溶液显中性,即c(H+)= c(OH-),则c(Na+)=c(HA-)+2c(A2-),故C错误;
D.F点恰好生成Na2A溶液,存在的电荷守恒式为c(Na+)+ c(H+)= c(OH-)+c(HA-)+2c(A2-),故D错误;
故答案为A。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目